Continuamos con esta serie de Química Orgánica. Por ahora seguiremos el orden establecido y hoy, como ya aprendimos a nombrar los hidrocarburos saturados, vamos a hablar de otro tipo de Hidrocarburos, los insaturados.
Pero antes, como siempre, vamos a corregir los deberes que, estoy seguro, todo el mundo habrá hecho (y si no, ¿por qué motivo estás leyendo esto?): Vamos allá. Recordemos que eran sólo tres. El primero era muy fácil, el truco estaba en ver que esto:
Es lo mismo que esto:
Lo único que hacía falta era contar cuantas veces había un vértice, podemos contar 5, y como dijimos (si no lo recordáis, volved al artículo anterior) en cada vértice hay un Carbono con sus Hidrógenos correspondientes, así que si tenemos 5 Carbonos “ocultos” y 2 en los extremos tenemos un total de 7 Carbonos (es más fácil contar en la de abajo) así que nuestra molécula es fácil de nombrar, 7 Carbonos e hidrocarburo saturado = Heptano.
El segundo ya era más difícil, pero si se habían entendido los ejemplos anteriores no tenía que suponer ningún problema, era incluso más fácil que el primero (ya que este era totalmente metódico), vamos a verlo:
Éste no lo voy a hacer yo paso a paso, voy a decir las respuestas a cada “paso” y si no lo tenéis igual que yo, dejad de leer y buscad la diferencia:
- La cadena más larga es de 7 Carbonos (y hay dos posibilidades, da igual la opción que escojáis).
- La numeración tiene que empezar en el Carbono que está más arriba o el que está más a la izquierda (depende de la cadena que hayas escogido). Si alguien ha empezado por el de abajo a la derecha lo ha hecho mal.
- Los radicales son: un metilo y un etilo
- El orden es: etilo, metilo (orden alfabético, recordad)
- El etilo se encuentra en el átomo 4 (independientemente de la cadena)
- Solo hay un etilo así que no tendrá prefijo
- El metilo está en el átomo 2 (independientemente de la cadena)
- Como solo hay un metilo no tendrá prefijo
- La cadena principal tiene 7 Carbonos así que será heptano
Juntando toda la información tenemos:
4-Etil-2-metilheptano
Y finalmente la tercera molécula, la más difícil de todas –aunque posible, sin duda.
Aquí está claro que la cadena más larga es el ciclohexano, y, como no tiene ni principio ni fin, podemos empezar la numeración donde queramos (teniendo en cuenta que debemos tener los radicales con el mínimo localizador).
Así que lo mejor será empezar con el 1 en el radical que está más abajo y numerar en el orden de las agujas del reloj.
Como tenemos tres radicales metilo, en los localizadores (1[1], 2 y 4).
Así que se nombra como 1,2,4-Trimetilciclohexano.
Éste último, como dije, no lo había explicado antes, y es perfectamente normal si no os ha salido, solamente un aviso: a la hora de escoger la cadena principal los cíclicos no se pueden romper, es decir, no puedes coger una parte del cíclico para formar la cadena principal y la otra parte considerarla una ramificación. O coges el cíclico entero o no coges ningún Carbono de éste (podemos ver que cogiendo sólo algunos Carbonos, en el ejemplo de arriba podemos escoger una cadena de 8 Carbonos, pero, como he dicho, estaría mal).
Si os han salido todos, enhorabuena. Si no… es vuestra decisión: si creéis que habéis entendido el artículo anterior, seguid, pero creo que os iría bien hacer una segunda lectura al artículo anterior.
Hidrocarburos insaturados (cadena abierta)
Vamos con los Hidrocarburos insaturados. En primer lugar, ¿qué diablos son los hidrocarburos insaturados?
Sabemos qué son los hidrocarburos, moléculas orgánicas formadas únicamente por átomos de Hidrogeno y Carbono, pero… ¿insaturados?
Si recodáis qué eran los saturados, podréis intuir qué son los insaturados, ya que los primeros eran las moléculas que tenían todos los Carbonos unidos por un enlace simple. Pues bien, los insaturados son las moléculas que tienen por lo menos un Carbono que no está unido por un enlace simple.
Vamos a ver ejemplos de los nombres de algunos hidrocarburos insaturados: Eteno, propeno (aunque se conoce más como propileno), 1-buteno, Etino, Propino…
Vamos a empezar por el principio: los insaturados son moléculas más complejas que las saturadas y además hay muchas más posibilidades, así que hay más clasificaciones. Vamos a empezar por lo más simple dentro de estos, los denominados Alquenos((Si recordáis el artículo anterior, os acordaréis de que dijimos que a los saturados también se les llamaba a veces Alcanos.)):
Alquenos:
Los Alquenos se caracterizan por tener tanto enlaces simples (C-C) como enlaces dobles (C=C).
Ya vimos un ejemplo de este tipo, el C2H4,que por entonces no dije que ése era el Eteno
Recordemos que para no escribir tanto el eteno se puede escribir en fórmula semidesarrollada, así que vamos a verlo:
Y, al igual que los Alcanos tienen una nomenclatura bastante fácil, vamos a hacer una tabla:
| Eteno | Et- (2 Carbonos) | H2C=CH2 | |
| Propeno | Prop- (3 Carbonos) | H2C=CH-CH3 | |
| 1-Buteno | 1-(el enlace está entre los átomos 1 y 2) | But- (4 Carbonos) | H2C=CH-CH2-CH3 |
| 2-Buteno | 2-(el enlace está entre los átomos 2 y 3) | But- (4 Carbonos) | H3C-CH=CH-CH3 |
A partir de esta tabla podemos sacar algunas conclusiones. Primero de todo, igual que los Alcanos terminaban en -ano, los Alquenos siempre terminarán con el sufijo -eno. Por otra parte, como podemos observar, se tiene que marcar el lugar donde está el enlace doble, esto es importante, porque como siempre el 1-buteno y el 2-buteno no son iguales en propiedades y es importante distinguirlos. De igual forma que con los radicales, si hubiese dos dobles enlaces en una misma molécula se debe indicar con un prefijo (di-, tri-, etc.).
No voy a hacer demasiado énfasis en esto, ya que nombrar los Alquenos es igual a nombrar los Alcanos, sólo con esta pequeña diferencia de señalar dónde está el enlace doble, pero ya practicaremos cuando hagamos ejemplos más complejos, así que pasemos a los hidrocarburos insaturados ramificados.
NOTA: En la última actualización de las normas IUPAC se ha cambiado un poco la forma de nombrar estos compuestos. Yo voy a usar el nombre antiguo, que es la manera en que me enseñaron a mí, y a lo mejor cuando la serie esté terminada hago un artículo especial dedicado a la nueva nomenclatura.
Radical Alquenilo
Antes de empezar las ramificaciones, como siempre presentaré el radical alquenilo, que como podéis deducir es muy parecido a los radicales alquilo.
Al igual que los Alquilos, los Alquenilos son Alquenos, los cuales han perdido un Hidrógeno, así que tienen un Carbono (igual que antes, generalmente en el extremo de la cadena, pero no siempre) al que le sobra un electrón de valencia. Nombrarlos es igualmente facil, toman el nombre de el Alqueno del que proceden, cambiando el sufijo -eno por el sufijo -enilo.
Los radicales Alquenilo no suelen enseñarse a nivel básico (por lo menos a mí ni me mencionaron su existencia), así que tampoco los pondré en los ejemplos (ni en los deberes). Pero creo que debéis conocer su existencia, sobre todo de dos de ellos, puesto que todos los amantes de la música seguro que han escuchado más de una obra brillante con un disco de Etenilo.
Dos de los Alquenilos más conocidos:
| Radical | Nombre | Nombre “común” |
| CH2=CH- | Radical Etenil | Vinilo |
| CH2=CH-CH2- | Radical 2-Propenil | Alilo |
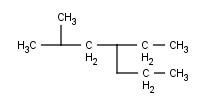
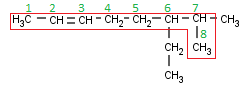
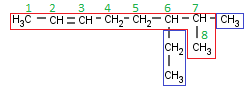
Ahora sí, vamos a ver algunos ejemplos de hidrocarburos insaturados ramificados, porque estos se nos complican bastante. Primero algo fácil y os voy explicando todos los pasos:
Como siempre vamos a escoger la cadena principal. Aquí las normas cambian un poquito. Antes, recordemos, la cadena principal era la que tenía más Carbonos. Ahora no: la ley suprema es tener el máximo de dobles enlaces dentro de la cadena principal y, de las posibles cadenas, la más larga.
Aquí podemos ver 3 posibles cadenas que contienen el doble enlace, de las cuales todas ellas tienen 8 Carbonos. ¿Da igual la que elijamos? Pues no, esta vez no, hay dos que sí son equivalentes, pero hay una tercera que no lo es. Vamos a identificar las tres cadenas:
- La que empieza por la izquierda y, al tercer Carbono de la derecha, va hacia abajo.
- La que empieza por la izquierda y, al segundo Carbono de la derecha, va hacia abajo.
- La que empieza por la izquierda y termina recto a la derecha.
Las cadenas 2 y 3 son equivalentes, pero la número 1 es diferente a las otras dos, recordemos la otra norma, se debe escoger la cadena más ramificada, así que vamos a ver cuántas ramificaciones tiene cada cadena:
- Tiene 1 ramificación, en el 6º Carbono empezando por la izquierda (justo antes de empezar a bajar). A su vez esa “rama” se divide en dos “subramas”, pero eso no nos importa ahora.
- Tiene 2 ramificaciones, en el 6º y 7º Carbono empezando por la izquierda.
- Tiene 2 ramificaciones, en el 6º y 7º Carbono empezando por la izquierda.
Así que debemos escoger la cadena 2 o la 3 (ahora sí que da igual la que escojamos) pero nunca la 1 (de hecho, si escogiéramos la 1 tendríamos una ramificación que, a su vez, está ramificada, algo que no tengo intención de explicar en esta serie[2] ) yo personalmente escogeré la cadena número 2:
Los insaturados también afectan cuando tenemos que poner localizadores. Antes, al numerar decía que teníamos que tener los radicales con el localizador más bajo posible. Ahora no: el doble enlace es mucho más importante que los radicales, así que lo que tenemos que conseguir al numerar es que el doble enlace tenga el localizador más bajo posible (y recordad el orden de prioridades, porque se complicará más en el futuro, así que, si lo tenéis claro desde el principio, más adelante no tendréis tantos problemas). Por lo tanto mi numeración queda así:
Y, ahora sí, localizamos los radicales:
Un metilo y un etilo, ya tenemos toda la información que necesitamos, así que como siempre vamos a nombrar:
- Localizador del primer radical (recordad: orden alfabético): [6]
- Nombre del primer radical (recordad el prefijo, aunque en este caso no sea necesario): [6-etil]
- Localizador del segundo radical: [6-etil-7]
- Nombre del segundo radical: [6-etil-7-metil]
- El nombre de la cadena (recordad que debemos indicar dónde está el doble enlace):
6-Etil-7-metil-2-octeno
Supongo que algunos de vosotros os preguntaréis por qué 2-octeno y no 3-octeno. Bien, cómo podemos observar el doble enlace no está en ningún Carbono, sino entre dos, pues bien…
¿Cómo podemos saber el localizador del doble enlace?
Es importante darse cuenta de que, aunque no tiene un número concreto está entre dos Carbonos seguidos. Es decir, está entre el Carbono con localizador x y el Carbono con el localizador x+1 (en el caso de arriba está entre los Carbonos 2 y 2+1=3). Así que, si nos fijamos en cómo hemos nombrado el ejemplo de arriba, podemos llegar a la conclusión de que el localizador del doble enlace será x.[3]
Ahora vamos a ver otro grupo de Hidrocarburos insaturados, los Alquinos. Como veremos, son muy similares a los Alquenos, y por esto no hago más ejemplos ni complico mucho más estos, ya que lo veremos con los Alquinos.
Alquinos:
Recordemos lo que hemos dicho al inicio del artículo. Los Hidrocarburos insaturados eran más complejos que los saturados, hemos visto el caso más “simple” y ahora vamos a ver el más “complejo”, lo pongo entre comillas porque en realidad, lo que nos interesa a nosotros (la formulación) es prácticamente igual a los Alquenos.
Una vez dicho ésto vamos a empezar explicando qué diferencia los Alquinos de los Alquenos (y de los Alcanos, evidentemente). Es muy simple, y podríais adivinarlo vosotros mismos, recordemos que había tres tipos de enlaces covalentes: el simple, el doble y el triple. Y hasta ahora hemos visto que cuando los Carbonos se unen por enlaces simples tenemos Alcanos, si se unen por enlaces simples y dobles tenemos Alquenos, por lo tanto tenemos Alquinos cuando… exacto, tenemos una molécula unida por enlaces simples y enlaces triples.
En este caso también hemos visto uno antes, el Etino:
Si han quedado claros los Alquenos no tengo que explicar nada de los Alquinos, simplemente se diferencian por el sufijo, los Alcanos terminan en –ano, los Alquenos terminan en –eno y los Alquinos terminan en –ino. (Etano, Eteno, Etino/Propano, Propeno, Propino…). Y, al igual que los Alquenos, se debe indicar el número de enlaces triples con un prefijo.
Algunos ejemplos de Alquinos
| CH≡CH | Etino[4] |
| CH≡C-CH3 | Propino |
| CH3-C≡C-CH3 | 2-Butino |
| CH3-C≡C-C≡CH | 1,3-Pentadiíno[5] |
| CH≡C-CH2-C≡C-CH2-CH3 | 1,4-Heptadiíno |
Radical Alquinilo
Después de ver los Alquilos y los Alquenilos, nos falta ver los Alquinilos (no confundir con Alquilos, aunque se parecen en el nombre). Bueno, como siempre… se trata de un Alquino al que le falta un Hidrógeno, y se nombran, igual que el Alquino del que proceden, cambiando el sufijo -ino, por el sufijo -inilo.
Como ejemplo solo pondré el Radical Etinilo (CH≡C-)
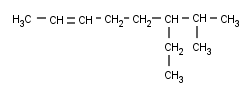
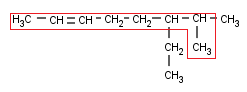
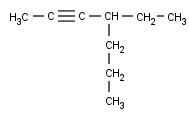
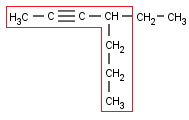
Y, finalmente, como siempre, después de los radicales nos toca hablar de los Alquinos ramificados. Vamos a ver algunos ejemplos:
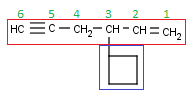
Escogemos la cadena principal. Hay dos que contienen el triple enlace (al igual que en los Alquenos, el doble enlace era prioritario a las ramificaciones, aquí, el triple también lo es) , pero una es más larga que la otra. Por lo tanto, aquí no hay discusión posible:
La numeración también es fácil, porque el triple enlace está bastante cerca de uno de los extremos (igual que antes, el triple enlace debe quedar con el mínimo localizador, el radical pasa a ser secundario):
Y sólo hay un radical, el etilo.
Creo que ya sois mayorcitos como para sacar el nombre solitos sin que vuelva a recordar los pasos por enésima vez.
…
…
…
…
Si os ha salido 4-Etil-2-heptino tengo que felicitaros. Si no… os recomiendo que volváis a leer este artículo desde arriba (o repasar en anterior).
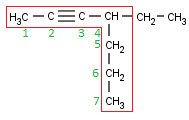
Ahora vamos a ver algo que puede que alguno ya esté imaginando. Vamos a juntar todo lo aprendido hasta ahora en un solo compuesto:
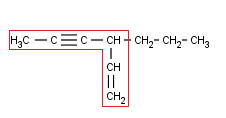
Marcamos la cadena principal. Que a nadie se le ocurra marcar la más larga, cómo he dicho más arriba, ya no nos interesa la cadena más larga sino la que tiene más dobles o triples enlaces.
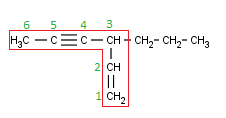
La numeramos (en este caso, ni el doble ni el triple enlace tienen prioridad sobre el otro, así que se busca que los localizadores de ambos sean lo más bajo posible):
Para nombrar estos compuestos tenemos que seguir un esquema nuevo (de hecho, hasta ahora, usábamos un caso concreto de este esquema):
| Localizador (Radical) | + | Radicales (Orden alfabético) | + | Localizador (doble enlace) | + | Prefijo (di, tri) | + | en | + | Localizador (triple enlace) | + | ino |
En nuestro caso, el localizador del radical es 3; el radical, un propilo; el doble enlace se encuentra en el Carbono 1 y el triple enlace en el Carbono 4.
Así que, si juntamos todo lo que acabo de decir, con el orden correspondiente, nuestra molécula es, nada más y nada menos que:
3-Propil-1-hexen-4-ino
No voy a poner más ejemplos, porque esto se va a hacer eterno y aún tenemos que hablar de los cíclicos…
Hidrocarburos Insaturados (cíclicos)
Aquí, por suerte, no hay mucho que decir, es igual que los Alcanos, simplemente que, como en los de cadena abierta, se prioriza el insaturado antes que la ramificación cuando se ponen los localizadores.
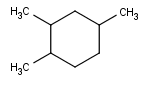
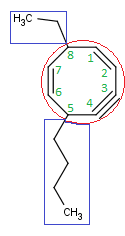
Veamos un ejemplo:
Empezamos la numeración en el doble enlace. Ahora podemos numerar en sentido horario o antihorario. La primera haría que el radical estuviera en el Carbono 3, mientras que la segunda opción nos dejaría el radical en el Carbono 5, así que numeramos desde el doble enlace en sentido horario.
Por lo tanto, como tenemos un radical metilo en el Carbono 3, nuestra molécula se llama…
3-Metilciclopenteno
No es incorrecto escribir 3-metil-1-ciclopenteno, pero al ser una molécula cíclica y dar prioridad a los dobles enlaces, éste siempre estará en el Carbono 1, así que tampoco es incorrecto dar por supuesto el localizador del doble enlace.
Vamos a ver un Alquino cíclico:
Y aprovecho para presentaros, ahora sí, un radical muy especial: el isopropilo. Es uno de los dos radicales especiales que tengo pensado presentaros en esta serie. Es especial porque parece que se trate de un radical ramificado, pero en realidad no lo es: simplemente se trata de un radical propilo que, en lugar de unirse por uno de los átomos del extremo, se une por el átomo del medio. Aparte de esto, funciona como un radical propilo normal. Evidentemente, como seguramente ya penséis, se tiene que diferenciar del radical propilo normal, y por eso su nombre es isopropilo.
Una vez presentado el isopropilo, volvamos a la molécula.
Vemos que la molécula es muy parecida a la otra, tiene el mismo número de Carbonos en la cadena principal, el triple enlace en el mismo sitio y el radical en el mismo sitio. Así que será igual que la otra: empezaremos numerando en el triple enlace y el isopropilo quedará unido al Carbono 3.
Por lo tanto, nuestra molécula será 3-Isopropilciclopentino.
Y para despedirme haré un cíclico que contenga dobles y triples enlaces. Antes de nada, aunque no era mi intención principal, me ha salido un compuesto un tanto puñetero, ya veréis el porqué (por cierto, gracias a J por darse cuenta, porque yo fui tan deprisa al escribir el compuesto que se me había pasado que hay otra opción):
Bonito, ¿eh?
Bien, aquí lo tenéis, con su cadena y su numeración:
Aquí es donde J, muy atento, me ha hecho ver una cosa, que también se puede empezar a numerar por abajo (el Carbono 4 de la numeración que enseño) y seguir el sentido antihorario.
En este artículo no he dicho nada, pero si aún os cuesta poner los localizadores -a veces cuesta bastante-, os recomiendo que hagáis lo que os enseñé en el artículo anterior. En este caso, al ser cíclico es bastante pesado hacerlo (ya que hay 16 posibles numeraciones aunque algunas se descarten muy rápidamente), aún así voy a repetirlo (sin tantos colorines, así que os recomiendo que tengáis el dibujo de arriba siempre visible, ya que puede que os cueste seguir el siguiente párrafo). Vamos allá:
Ahora voy a complicarme la vida, y es posible que éste párrafo sea bastante confuso y pesado, así que te recomiendo, si lo tienes claro, que te lo saltes, y si no lo tienes claro, coge un lápiz, una goma y un papel y ve dibujando todo lo que diga (y lee varias veces cada frase).
Como he dicho, hay 16 cadenas distintas, y no las voy a dibujar todas (ya sois mayorcitos) así que voy a establecer un convenio para nombrar las cadenas:[6] Para identificar una cadena necesitamos dos cosas, saber donde empieza (cuál es el Carbono 1) y cuál es su sentido. Pues bien, coged como referencia la cadena de la imagen, ahora tenemos todos los Carbonos numerados,[7] y luego voy a utilizar las letras H y A para decir si el sentido es Horario o Antihorario. De modo que la cadena del dibujo sería la cadena 1H (el Carbono 1 de la cadena está en el que nosotros hemos nombrado Carbono 1, y va en sentido horario). Bien una vez entendida la nomenclatura ya podemos empezar (no sigas leyendo si no has entendido la nomenclatura).
Vamos a ver que realmente hay 16 cadenas, nombremos todas las cadenas que veamos: 1H, 2H, 3H, 4H, 5H, 6H, 7H, 8H, 1A, 2A, 3A, 4A, 5A, 6A, 7A y 8A. Evidentemente, hay 16 posibles cadenas. Naturalmente sólo podemos quedarnos con una de ellas, así que vamos a descartar cadenas con la información que ya sabemos sobre prioridades:
La primera norma (o sea, la que por ahora domina sobre las otras) es que los Insaturados deben tener el numerador lo más bajo posible. Así que vamos a analizar cadena por cadena (yo haré 6, vosotros hacéis las 10 que faltan):
1H: Tiene Insaturados en los Carbonos 1, 3 y 6
2H: Tiene Insaturados en los Carbonos 2, 5 y 8 (tened en cuenta que ahora, el que para nosotros es el Carbono 2, en la cadena 2H es el número 1)
3H: Tiene Insaturados en los Carbonos 1, 4 y 7
1A: Tiene Insaturados en los Carbonos 3, 6 y 8
2A: Tiene Insaturados en los Carbonos 1, 4 y 7
3A: Tiene Insaturados en los Carbonos 2, 5 y 8
…
…
…
Bien, espero que todos hayáis visto que los que tienen los Insaturados en los localizadores más bajos son la cadena 1H y 4A (con los insaturados en los Carbonos 1, 3 y 6)
Bien, nos hemos quedado con 2 cadenas de 16… Está bastante bien, pero no nos basta, sólo puede quedar una. Así que la decisión es fácil, ya que tienen los insaturados con el localizador más bajo posible vamos a usar la siguiente “norma”: la cadena principal es la que tenga los radicales en los localizadores más bajos. Pues vamos a ver cuál de las dos cumple esta condición y ya habremos terminado:
1H: Tiene un radical butilo en el Carbono 5 y un radical etilo en el Carbono 8
4A: Tiene un radical etilo en el Carbono 5 y un radical butilo en el Carbono 8
Pues evidentemente nuestra cadenas es… como ya he dicho era un compuesto puñetero, ninguna de las dos cadenas tiene prioridad sobre la otra, pero claramente no son equivalentes (si formulamos el compuesto, éste será diferente según si escogemos la cadena 1H o 4A), cómo escogemos la cadena principal… Hemos aplicado los dos “filtros” que sabíamos para escoger cadena… y seguimos con dos posibilidades. Aquí viene una nueva norma que yo no conocía hasta que me encontré con esta molécula:
- En el caso de que hay dos posibles formas de nombrar un compuesto, el doble enlace tendrá ventaja sobre el triple
Por lo tanto, como la cadena 1H tiene un doble enlace en los Carbono 1,6 mientras que la 4A en los Carbonos 3,6, la cadena 1H es la correcta, y nuestro compuesto se formula:
5-Butil-8-etil-1,6-cicloctandien-3-ino
Espero que no os haya liado mucho este compuesto, lo más importante de él era ver cómo formular compuestos que tienen dobles y triples enlaces. Si eso lo habéis entendido no hace falta que os preocupéis de escoger la cadena (aunque siempre es recomendable, ya que, aunque no creo que volváis a verlo, siempre está bien saberlo).
Y antes de terminar este artículo, voy a proponeros un reto (sí, sé que éste artículo os estará resultando largo y pesado). Tenía pensado dejar este compuesto para que lo hicierais solos en casa, pero creo que es complicado hacerlo sin que antes os haya hecho algún ejemplo (lleváis claro que van a caer varios de estos en los deberes, y más difíciles). Se trata de compuestos cíclicos como ramificaciones de una cadena, por ejemplo:
En verdad no tiene mucha dificultad, y muchos podríais hacerlo solos.
Solo debes tener muy presente que, al buscar la cadena principal, además de tener una de 6 Carbonos frente a una de 4 (claramente ganaría la de 6) tienes alquenos y alquinos en la cadena abierta, lo que hace que la cadena principal tenga que ser precisamente ésa. Una vez tienes claro esto, sólo debes pensar cómo nombrar el radical (butilo no, evidentemente); pero primero veamos marcada la cadena principal, su numeración y los radicales:
El radical evidentemente debe llamarse [3-ciclobutilo] (no hará falta que explique que el 3 es por el localizador, el ciclo- porque es un hidrocarburo cíclico, el -but- porque tiene 4 Carbonos y el –ilo porque es un radical Alquilo ¿verdad?).
Pues bien, una vez nombrado el único radical, la cadena es lo mismo de siempre, 6 Carbonos, con un doble enlace en el Carbono 1 y un triple enlace en el Carbono 5: 1-hexen-5-ino.
Por lo que el compuesto entero queda:
3-Ciclobutil-1-hexen-5-ino
Y hasta aquí el artículo de hoy, si el nombre de 3-ciclobutil-1-hexen-5-ino os parece largo, raro y complicado… esperad a ver lo que sigue.
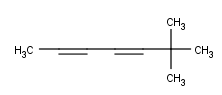
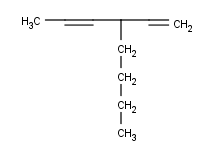
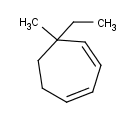
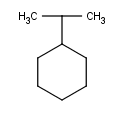
Y como siempre, algunos ejemplos para que podáis practicar en casa:
Bueno, son cinco. Mi recomendación es, como siempre, hacerlos todos, pero si no tienes tiempo haz solamente algunos, ¡pero haz algo, por Dios![8]
- Un radical sólo estará en el Carbono 1 si hablamos de una molécula cíclica, ya que si no es cíclica el radical pasa a formar parte de la cadena principal, alargándola. [↩]
- Los que ya sepáis de química orgánica habréis visto que esto en realidad es un isopropilo (en cuyo caso, ¿qué hacéis leyendo esta serie?). Sí que tengo intención de explicar el isopropilo más adelante, pero cuando aparezca uno de verdad. [↩]
- siendo x, recordemos, el localizador más bajo de los Carbonos que une [↩]
- Acetileno para los amigos [↩]
- como hasta ahora no habiamos topado con uno de estos no lo habia dicho, pero el prefijo debe ir justo antes de el sufijo -ino, ya que si dijeramos dipentino, estariamos diciendo que hay dos moléculas de pentino [↩]
- AVISO: Esto no tiene nada que ver con la química orgánica, esta manera de nombrar cadenas acabo de inventármela yo para intentar que nos entendamos mejor. [↩]
- OJO: me voy a hacer pesado con las notitas estas, pero es de vital importancia entenderlo, esta numeración de Carbonos es arbitraria, no nos basamos en nada más, es sólo para que si yo digo “el Carbono 5″ sepáis a qué Carbono me refiero. [↩]
- AVISO: Ninguno es difícil, ¡pero hay uno que tiene trampa! [↩]

The [Química Orgánica] II-Hidrocarburos Insaturados by Roger Balsach, unless otherwise expressly stated, is licensed under a Creative Commons Attribution-Noncommercial-No Derivative Works 2.5 Spain License.






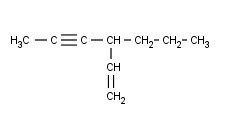




{ 16 } Comentarios
Pensé que mencionarías la estereoisomería cis-trans de los alquenos. Por otro lado, el triple enlace del carbono es lineal, asi que es un poco chocante ver la representacion en zig-zag del etino. Entiendo que es un detalle que no tiene importancia a la hora de hablar de nomeclatura, pero no podia dejar de mencionarlo. Por el mismo motivo el ciclopentino seria terriblemente inestable.
Oye Roger, en el cuadro de los radicales alquenilos por qué el segundo ejemplo lo nombras como radical 2-propenil y no radical 1-propenil. Esto es un lío sublime.
Carlos, como digo en la presentación, mi idea para la serie es basarme en la formulación y nomenclatura de los compuestos. Por lo que, en principio no voy ha hablar de isomerías, por otra parte, no descarto escribir un o dos anexos hablando también de isomerías una vez terminada la serie…
jreguart, supongo que tu duda viene de que hasta ahora hemos dicho que el doble enlace debe ser prioritario y por eso deberíamos empezar a numerar el radical por el doble enlace ¿no? Bien, aunque me gusta que hagas esta pregunta (significa que estás entendiendo las cosas), lo que pasa es que los radicales están unidos a una cadena principal, por lo que siempre se numerará como Carbono 1 aquel que esté unido a la cadena. Por lo tanto, el radical 1-propenil que propones tu sería (CH3-CH=CH)-, ya que ahora sí, el carbono que tiene el doble enlace es el que está unido a la cadena principal.
Espero que se entienda Roger
Perfecto. Y gracias.
Roger : me prometes que en un futuro cercano abordarás el tema de como guardan energía las moléculas ; en ninguna parte he podido encontrar una explicación razonablemente entendible . o son demasiado básicas o demasiado complejas ; creo que he llegado al lugar y persona indicados .
Kekulé, no sé si termino de entender a lo que te refieres cuando hablas de “cómo guardan energía las moléculas” supongo que te referirás a los conceptos de entalpía, entropía y energía libre de Gibbs ¿no? (Si, por ejemplo, te refieres a cómo “guardan” la energía las moléculas como el ATP, entonces es lo que he dicho).
Primero, cuando termine ésta serie tenia pensado preguntar a los lectores (si aún mantengo alguno al final de la serie, que con el ritmo que llevo ya seremos todos tan veteranos como Mac) que propusieran ideas para otras series, así que puede que tenga en cuenta la tuya (está claro que antes de todo esto tendrá que caes una serie o mini-serie sobre formulación inorgánica).
La verdad es que el tema de cambios de energía de reacciones nunca me ha llamado la atención y yo preferiría alguno de reacciones REDOX o cinética. Pero ya veremos…
Aparte de todo esto, incluso en el caso de que haga ésta serie (puedes volver dentro de dos o tres eones para ver si ya he empezado) creo que el nivel será bastante básico, por una única razón, mis conocimientos de química son más bien escasos, y estos temas suelen tratarse con más profundidad en biología que en química.
Roger
ROGER : mi duda está relacionada con la energía que se necesita para romper o sintetizar una molécula o un enlace iónico ; cuales son los principios que gobiernan las fuerzas que los mantienen unidos ; por ejemplo una simple molécula de agua o una mas compleja molécula de glucosa .
Roger : se me ocurre el siguiente experimento ; si tengo 1000 cc de agua destilada y le aplico electricidad con un voltage y amperaje previamente conocidos y obtengo hidrógeno y oxígeno ; con una fórmula que me imagino que existe pero desconozco ahora ; ¿ puedo convertir esos watts de electricidad en calorias , julios … energía al fín y al cabo . y con la ley de avogadro sabré cuantas moléculas hay en ese litro de agua y cuantas se disociaron , y por lo tanto la cantidad de energía (calorías , julios) que hay en una molécula de agua ? .
Kekulé: En tu primer comentario supongo que haces referencia al concepto de entalpía, dicho mal y pronto, para destruir un enlace cualquiera es necesario aportar una cantidad de energía determinada, mientras que, al formar un enlace cualquiera se desprende una energía determinada. Por ejemplo la formación de fluoruro de hidrógeno: H2 + F2 –> 2H+ + 2F- –> 2HF Es necesario aportar cierta energía para que los enlaces covalentes que unen los dos hidrógenos y los dos flúor se rompan. Pero luego la unión de un hidrógeno y un flúor para dar el fluoruro de hidrógeno desprende energía. Si calculamos la energía neta (la energía necesaria para romper los enlaces menos la energía que se desprende de la formación de enlaces) obtenemos la energía que debemos aportar a sistema para la reacción (si es negativa es que no debemos aportar energía y que será la reacción la que desprenda energía). A eso llamamos la variación de entalpía.
Por ejemplo: -Las combustiones son todas exotérmicas (es decir desprenden energía, variación de entalpía negativa) como puedes comprobar al quemar cualquier cosa. -Si te has dado un golpe fuerte alguna vez, posiblemente te hayan puesto unas bolsitas llenas de un líquido azul que están muy frías, ahí dentro se producen reacciones endotérmicas (absorben energía, variación de entalpía positiva).
En cuanto a la pregunta de “cuales son los principios que gobiernan las fuerzas que los mantienen unidos” básicamente se trata de la fuerza de Coloumb. Aunque podría explicarte más o menos lo que es, Pedro le dedicó todo un artículo: http://eltamiz.com/2009/10/20/electricidad-i-ley-de-coulomb/
Luego, en tu segundo comentario: He intentado pensar como explicar esto sin alargarme mucho, pero el tema que trata esto son las reacciones REDOX, y no es nada fácil explicar de forma clara y corta.
Así que, básicamente piensa en tu experimento como lo que he explicado antes, no puedes saber la energía que tiene el agua, pero puedes calcular la variación de entalpía de la formación de agua (al contrario de lo que tu dices) 2(H2) + O2 –> 2(H2O).
Espero que algo te haya aclarado, y que el comentario no sea demasiado pesado… Roger
Róger : mi tema apunta a que las formulas desarrolladas , empíricas etc . dan algunos datos sobre las moléculas , pero no sobre la energía en ellas contenida ; se dice que la glucosa contiene 680 kcal el mol. casi 4 kcal por gr . en otros lados se habla del valor energético de los enlaces : c-c , c-o , o-h , n-h etc . mi pregunta es que si a partir de estos últimos valores se puede deducir la cantidad de energía de una molécula .¿ o definitivamente esto es puro academicismo? …. no quiero complicarte la vida Róger ni hacer esto espeso y ademas se también que escapa al propósito de este trabajo , pero cuando veo una fórmula quiero saber mas sobre ella ; me eh informado sobre los puentes de hidrógeno los enlaces de van der waals dipolo- dipolo , con respecto a esto último si se que energía porta un puente de hidrógeno entre dos moléculas de agua puedo deducir aprox. la que hay en valores macro ?.
Kekulé: Me parece que estoy empezando a entender tu pregunta (aunque solo me lo parece).
Primero de todo, “se dice que la glucosa contiene 680 kcal el mol.” no se que es lo que se entiende al decir que la glucosa contiene X kJ/mol, pero dado que la variación de entalpía de combustión de la glucosa es aprox. -2813 kJ/mol (lo que equivale a unas 673 kcal/mol) supongo que te referiras a ésto (si no es así lo siento mucho)
Por cierto, como he dicho en el comentario anterior la variación de entalpía de combustión de la glucosa és la variación de entalpía de la reacción de combustión de la glucosa. Dado que esta reacción es: C6H12O6 + 6(O2) –> 6(CO2) + 6(H2O) Quiere decir que en esta reacción, al producirse, se liberan 2813 kJ
Entonces tu pregunta es si, a partir de los valores de energía de los enlaces es posible obtener la variación de entalpía de una reacción. Mi respuesta es que sí. A partir de las energías de los enlaces se obtiene una variación de entalpía de -2797kJ (no voy a poner aquí todos los cálculos necesarios para obtener este valor ya que ocupan un espacio bastante grande, si te interesan puedo enviarte un mensaje privado, no son nada complicados, solo sumas y productos).
Espero haber acertado con la respuesta y que me haya explicado suficientemente bien. Roger
Roger : gracias por tu respuesta . voy a complementarla como tu me sugieres con Pedro en termodinámica y electricidad . ahora tengo otra duda ; cuando tengo una molécula apolar por ejemplo como el metano en la cual no hay puentes de hidrógeno para mantenerlas en ese vaivén que mantiene tan bien a las de agua . ¿que fuerza las mantiene cerca ? ó también es el mismo principio con la diferencia que el átomo de carbono con menos masa protónica que el oxígeno mantiene por menos tiempo cerca de él al electrón del hidrógeno haciendo menos fuerte la atracción entre moleculas ? . ó simplemente arrancan lo mas lejos posible unas de otras (como un gas ) por efecto de la repulsión que genera tener nubes electrónicas frente a frente . recurrir a este principio – u otro que me recomiendes tu – me puede ayudar a entender el por que del comportamiento tan diferente de moléculas que en el papel se ven tan parecidas ; si me respondieras con algún ejemplo que grafique mejor la idea mejor todavía ; si es muy larga la respuesta me la envías a mi correo … ah . “kekulé” es por el sueño que tuvo este genio que descubrió la estructura del benceno mientras dormía , vió una serpiente mordiendo su cola y se le ocurrió la genial idea de la estructura en forma de anillo de dicha molécula …¡ soberbio !
Kekulé: No vas nada desencaminado. La verdad no estoy seguro de como son las fuerzas intermoleculares del metano. Pero por las que conozco, la única que podría explicarlo seria el enlace dipolo instantáneo-dipolo inducido. Como sabes, el metano es una molécula neutra y apolar (no tiene momento dipolar entre sus átomos). Lo que ocurre es que los electrones del carbono (imaginemos el átomo de manera clásica, teniendo en cuenta efectos cuánticos no tengo ni idea de como se explica esto) están dando vueltas a su alrededor, por lo tanto, generalmente el átomo de carbono es también neutro, pero es posible que, en un momento determinado, los electrones se concentren en una región concreta, lo que ocurre entonces es que se crea un momento dipolar en este átomo, transformando el metano en una molécula polar (dipolo instantáneo), luego estos electrones repelen los electrones de otros metanos, creando otro momento dipolar en las otras moléculas (dipolo inducido). A partir de aquí funcionan igual que cualquier enlace dipolo-dipolo (es decir, la parte positiva de la molécula atrae a la parte negativa de otra molécula). Este enlace es muy débil, y esta es la razón de que el punto de ebullición del metano sea muy bajo, de unos 112K.
Roger
Disculpa… quisiera pedir tu ayuda.. Lo que pasa es que tengo un compuesto con dobles enlaces y triples presentes pero al buscar la cadena más larga y elegirla como principal, esta queda un radical unido directo con doble enlace …. ¿cómo puedo nombra el sustituyente en estos casos?
Carmen, ¿hay alguna otra cadena posible que incluya todos los dobles y triples enlaces? Si la hay ésa es la principal, aunque no sea la más larga, si no es posible, leete en esta misma entrada los apartados de alquenilos y alquinilos.
Saludos, Roger
Buenos dias, me podria hacer el favor de ayudarme con la grafica del pentadeca para cadena abierta insaturada. me urge gracias. bendiciones
Escribe un comentario