En el último artículo de [esta serie] empezamos a ver tres grupos funcionales del Oxígeno; hablamos de Alcoholes, donde el Oxígeno ocupaba el sitio de un Hidrógeno y se unía mediante un enlace simple al Carbono. Luego hablamos de Aldehídos, donde el Oxígeno ocupaba el lugar de un Hidrógeno, pero se unía a él con un enlace doble y el Carbono se unía a un Hidrógeno. Y finalmente vimos las Cetonas, donde el Oxígeno ocupaba el sitio de un Hidrógeno, se unía con un enlace doble al Carbono y ése Carbono se unía a su vez con otro Carbono.
Hoy vamos a seguir con los grupos funcionales del Oxígeno hablando de los Éteres
Éteres
Una vez que hemos visto qué es lo que pasa cuando un Oxígeno se une al Carbono mediante un enlace simple y mediante un enlace doble en el medio y en los extremos de la cadena, tenemos que buscar más posibilidades. Como ya hemos visto lo que ocurre cuando el Oxígeno le quita el sitio al Hidrógeno, nos falta ver lo que pasa cuando el Oxígeno le quita el sitio a un Carbono. Si,habéis oído bien (bueno, más que oído, leído), un Oxígeno ocupa el sitio de un Carbono, uniéndose con enlaces simples, por una banda con un Carbono y por la otra con otro Carbono diferente (recordemos que el Oxígeno, aunque dispone de 6 electrones de valencia, solo usa dos para enlaces).
La prioridad de los Éteres es bastante poca; de hecho, están por debajo los Alcoholes, lo que los convierte en los compuestos oxigenados menos prioritarios. Así que el orden ahora queda así:
Aldehídos → Cetonas → Alcoholes → Éteres → Alquenos y Alquinos → Compuestos Halogenados → Radicales → Alcanos.
Vamos a ver la forma general de este grupo funcional:
Donde ya hemos visto que R1 y R2 son cadenas de este compuesto.
Nombrar estos compuestos, como ya he dicho, es muy parecido a la nomenclatura alternativa de las Cetonas. De hecho, se nombra exactamente igual, sustituyendo el “cetona” por “éter”.
Por ejemplo
Podemos identificar los dos radicales como radical Metilo y Propilo, y antes de nombrar debemos recordar que el orden de radicales se escribe siempre por orden alfabético, así que este compuesto es un Metil propil éter.
Y deciros que cuando ese compuesto no es el principal, en lugar de [R1 R2 éter] tenemos que escribir –oxi.
Bien, pero al igual que las cetonas, los éteres también pueden nombrarse de forma diferente (aunque, al igual que con las cetonas es más común usar la nomenclatura –ona, en los éteres lo más común es usar la nomenclatura radical+radical+éter, o sea, la que acabo de explicar).[1]
Bien, los éteres, además de la nomenclatura anterior, también pueden nombrarse como si fueran grupos secundarios.[2]
No os espantéis, aún no hemos formulado ningún compuesto con un grupo funcional oxígeno como grupo funcional secundario (aunque en todos y cada uno de los grupos os he explicado cómo se nombrarían en ese caso). El motivo por el que os voy a enseñar esta nomenclatura es más para hacer ejemplos con el éter como grupo secundario que para que sepáis una forma alternativa de nombrar, porque ya he dicho que es más común la anterior. ¿Y por qué quiero practicar con los Éteres si en ningún otro grupo lo hemos hecho? Pues porque los éteres son algo especiales.
Es posible que os hayáis percatado de eso cuando he dicho cómo se nombra un éter cuando no es el grupo funcional principal. Si no lo habéis notado, os dejo una tabla comparando los diferentes grupos hechos hasta ahora, a ver si lográis ver alguna diferencia:
| Grupo funcional | Nomenclatura como grupo funcional secundario |
|
Alcoholes |
Hidroxi- |
|
Aldehídos |
Formil- |
|
Cetonas |
Oxo- |
|
Éteres |
-oxi |
¿Ahora sí? Exacto, los éteres son los únicos que tienen un sufijo en lugar de un prefijo (ya os adelanto que no veremos ningún otro grupo al que le pase esto, básicamente porque, si existe, no lo conozco). Por esto quería verlos aquí. Pero bueno, creo que debería dejar de hablar tanto y deciros cómo se nombran los éteres de forma alternativa, porque llevamos algunos párrafos y aún no he dicho nada útil.
Bien, para nombrar, primero tenemos que identificar la cadena principal (en el caso de que el éter esté actuando como un grupo funcional secundario es fácil, tan sólo tenemos que escoger la cadena principal real), pero recordemos que en la nomenclatura alternativa el éter se nombra como grupo funcional secundario, ¡Pero el grupo funcional principal es justamente el éter! Pues bien, entre los dos radicales del éter debemos escoger el radical más largo.[3] Una vez escogido el radical adecuado, funciona como si el radical fuera la cadena principal y el éter, junto con el otro radical, la cadena secundaria.
Bien, es probable que no hayas entendido nada…[4] vamos a ver si con unos ejemplos la cosa queda más clara:
Este compuesto es el mismo que hemos visto antes, y habíamos quedado que lo nombrábamos como Metil propil éter ¿no? Pues bien, para nombrarlo de forma alternativa debemos identificar los radicales (Metilo y Propilo, ya lo vimos antes), y escogemos el más largo (el que tenga el número más grande de Carbonos), en este caso el Propilo. Entonces, consideramos el Propilo como cadena principal (entonces deja de ser un radical, por lo que, en lugar de Propilo, tenemos un Propano ramificado).
Después de esto debemos nombrar el resto de la cadena (el Éter junto al Metilo). Sabiendo todo lo que sabéis no os debería ser difícil deducir una aproximación de cómo se nombraría esto. Sabéis que para indicar el número de carbonos se usa el lexema de la palabra y que el éter se nombra con el sufijo –oxi. Así que si tenemos un carbono (con sus respectivos Hidrógenos, claro, no nos olvidemos de ellos) más un Éter se llama [Metoxi-].
Y ya está, solamente hace falta unir el radical Metoxi con su cadena principal [Propano], por lo tanto Metoxipropano. Es posible que sea algo complicado, por lo que vamos a hacer otro ejemplo para practicar las dos nomenclaturas (aunque ya os he dicho que, con que os aprendáis la primera, ya está bien).
Bien, vamos a nombrar éste compuesto de las dos maneras que conocemos:
Lo primero es identificar los radicales (lo que nos servirá para las dos nomenclaturas). Es bastante fácil ¿no? (por lo menos a estas alturas ya debería serlo), son dos radicales Etilo.
Así que, con la nomenclatura que me interesa el compuesto debe nombrarse como Dietil éter.
Recordad que con el prefijo di- ya dejamos claro que hay dos radicales etilo, por lo que no hace falta escribir etil etil éter.
La nomenclatura alternativa en este caso no nos permite acortar el nombre… es una lástima. Atentos a lo que viene ahora, porque es probablemente una de las cosas más difíciles y abstractas de la química (comparable solo con la teoría de cuerdas). Debemos escoger la cadena principal, en este caso no puedo explicaros el porqué, ya que serían necesarios varios artículos y conocimientos de química cuántica avanzada, así que debéis creerme cuando os digo que el radical que debemos escoger es el Etilo (si si, habéis leído bien, el Etilo, yo también me quedé en estado de shock cuando me lo dijeron).
Una vez escogida la cadena, como tenemos un radical Etilo unido a una cadena de Etano mediante un Oxígeno, lo que tenemos es Etoxietano.
Vamos con el siguiente grupo, de uno relativamente poco importante a otro importantísimo, los ácidos carboxílicos.
Ácidos Carboxílicos
Bien, una vez visto qué es lo que pasa cuando un Oxígeno ocupa el lugar del Hidrógeno o del Carbono, nos queda ver qué es lo que pasa cuando hay más de un Oxígeno. Ésto nos llevará dos grupos funcionales más, los Ácidos carboxílicos y los Ésteres. Los ácidos se forman, en un principio, igual que los Aldehídos y las Cetonas; hay un Oxígeno ocupando el lugar de un Hidrógeno mediante un doble enlace. Luego, recordemos que la diferencia entre las Cetonas y los Aldehídos era que las primeras unían el electrón sobrante con un Carbono y los segundos con un Hidrógeno, pues los ácidos unen este electrón sobrante con otro Oxígeno (que, como sólo puede compartir un electrón con el Carbono,[5] comparte el otro con un Hidrógeno, igual que hacen los Alcoholes). Su forma general es ésta:
Antes de terminar los éteres dije que los ácidos eran un grupo muy importante, pues vamos a ver cómo de prioritario son los ácidos frente a todo lo que hemos visto: los ácidos carboxílicos, en nuestra lista de importancia son los primeros, por encima de los Aldehídos. Por lo que nuestra clasificación queda así:
Ácidos → Aldehídos → Cetonas → Alcoholes → Éteres → Alquenos y Alquinos → Compuestos Halogenados → Radicales → Alcanos.
Pero lo que más nos interesa es saber cómo se llaman: un compuesto que tenga un ácido se nombra como Ácido R1-oico, o si se trata de un aromático, R1-benzen(di/tri)carboxílico.
Por ejemplo:
Éste se llamaría Ácido propanoico, ya que es una molécula de Propano con un Ácido carboxílico.
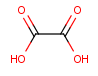
Este compuesto es una molécula de Etilo con un Ácido en cada Carbono, su nombre es Ácido etandioico.
Al ver estos dos ejemplos podemos ver que no hace falta indicar dónde se encuentra el Ácido, ya que sólo puede encontrarse en los extremos, aunque sí es necesario especificar si hay uno o dos grupos.
Voy a poner algunos ejemplos más, y además voy a poner los nombres comunes, ya que muchos Ácidos probablemente os suenen:
El primero es el más simple de todos los ácidos carboxílicos: el Ácido Metanoico. Más conocido como Ácido fórmico, una de las sustancias provocadoras del picor que producen algunas ortigas, la picadura de abejas y, como podréis deducir por su nombre… sí, la mordedura de algunas hormigas.
Otro muy conocido (que seguro que todos tenéis en casa y la mayoría de vosotros lo habéis injerido hoy mismo):
Esta molécula es el Ácido etanoico. Mundialmente conocido como Ácido Acético, lo que le da ese sabor (personalmente, tan repugnante) al vinagre.
Otro Ácido conocido y que tiene un nombre común es el que hemos hecho antes, el Ácido etandioico, que se le suele llamar Ácido oxálico (presente en algunas verduras).
El siguiente ácido, la verdad, no es tan conocido: Os presento el Ácido Ftálico o, dicho de forma más simple el Ácido O-benzendicarboxílico.
Esta vez no puedo deciros qué es lo que pasa cuando un Ácido no actúa como grupo principal, básicamente porque no hay ningún grupo que tenga más prioridad que los Ácidos.
Y como he hecho con los grupos Alcohol, Aldehido y Cetona, vamos a ver como se puede escribir un Ácido sin tener que hacer todo el dibujito, el Ácido lo veréis muchas veces escrito como (-COOH) o (HOOC-)
Pasemos ya al último grupo funcional de este artículo, los Ésteres.
Ésteres
Los Ésteres son muy parecidos a los ácidos (de hecho se derivan de estos), y están formados también por dos Oxígenos. De hecho, si recordáis lo que dijimos del ácido, pues el éster es prácticamente igual, dos Oxígenos unidos al Carbono, uno con doble enlace y el otro con enlace simple. La diferencia es que el Ácido terminaba la cadena, ya que el Oxígeno se unía a un Hidrógeno con el último electrón que quedaba, mientras que el Oxígeno del Éster actúa igual que lo hacían los Éteres, es decir se une –mediante un enlace simple- a otro Carbono, que puede seguir la cadena. Vamos a ver esto gráficamente:
Los Ésteres, igual que los Ácidos, son muy importantes, de hecho, los Ésteres en nuestra lista están justo después de los Ácidos. Así:
Ácidos → Ésteres → Aldehídos → Cetonas → Alcoholes → Éteres → Alquenos y Alquinos → Compuestos Halogenados → Radicales → Alcanos.
Y, finalmente, vamos a ver como se nombran estos compuestos, la cadena principal siempre es la R1 y se nombra esa con el sufijo –ato (o -oato), luego el compuesto R2 se añade el sufijo –ilo (es decir, se nombra como un radical). Quedando R1ato de R2il.
Vamos a ver un ejemplo
Este compuesto sería Etanoato de butilo, la primera cadena (etanoato) es la de la izquierda del Oxígeno (siempre será la que contenga el otro Oxígeno con doble enlace) y la segunda (butilo) es la de la derecha del Oxígeno.
Otro:
Como la cadena de la izquierda, que se trata de un Propano, tiene el Oxígeno, y la de la derecha es un Etilo, este compuesto se nombra Propanoato de etilo.
La verdad, si se ha entendido todo hasta aquí no hay nada difícil, aunque a lo mejor este artículo requiere que se lea varias veces, porque hay muchas nomenclaturas y muchas cosas nuevas.
Vamos a practicar un poco más con los Ésteres, pero vamos a tratar solamente ciertos Ésteres concretos. ¿Y por qué precisamente esos? Pues por una característica muy importante de los Ésteres. Muchos Ésteres son los responsables de dar a muchas frutas o flores su olor característico (hay algunos que simplemente son los que dan ese olor a la fruta, pero otros tienen ese olor, aunque, según he leído no son los responsables del olor de ésta fruta). Así que me ha parecido divertido compartir algunos aquí. Por ejemplo, vamos a ver un Éster con olor a albaricoque:
Se trata del Butanoato de Pentilo
Otro de los ésteres se usa para muchos medicamentos, pues es el que tiene olor a naranja, el Acetato de Octilo:
Por cierto, el Acetato de Octilo es lo mismo que el Etanoato de Octilo, por si no lo habíais supuesto ya.
Y finalmente, para escribir un Éster sin tener que hacer el dibujito usamos (-COO-) O (-OOC-), importante cuál de los dos usamos, porque no es lo mismo CH3-CH2-CH2-COO-CH2-CH3 (Butanoato de etilo) que CH3-CH2-CH2-OOC-CH2-CH3 (Propanoato de propilo)
Bien, hasta aquí el artículo de hoy que, aunque dividido en dos partes, ha sido el más largo y en el que he introducido más conceptos nuevos (aunque espero que no difíciles). Realmente aún podría explicar algunas cosas más, por ejemplo los ésteres metálicos, que son otros derivados de los Ácidos, sólo que el Oxígeno en lugar de unirse a un Hidrógeno se une a un metal. Se nombra igual que los Ésteres, solo que en lugar de, por ejemplo Etanoato de metilo, sería Etanoato de sodio.
Y los Haluros de aquilos, que también son derivados de Ácidos, donde el grupo OH se cambia por un Halogeno. Por ejemplo, Cloruro de etanoilo:
Pero vamos a dejar aquí el artículo.
Para que practiquéis mucho, os dejo unos cuantos ejercicios variados. ¡Hasta la próxima!
Sólo es necesario nombrar los siguientes compuestos, son bastantes (hemos visto muchas cosas nuevas). Espero que no os asustéis. Como siempre recomiendo hacerlos para ver si se va entendiendo la serie o no, esta vez acepto que hay alguno difícil, por lo que es normal si no os salen todos… pero bueno, intentadlo:
Hasta el próximo día.
- Curioso cuanto menos, porque la nomenclatura que recomienda la IUPAC es justamente la “alternativa” [↩]
- Es una nomenclatura que no me gusta demasiado… de hecho a mí nunca me la explicaron y es bastante común que, si la ves en algún sitio, esté mal… [↩]
- AVISO: la verdad, desconozco cómo se escoge la cadena principal si hay dobles o tiples enlaces, supongo que entonces estos tienen preferencia, pero no estoy seguro; si alguien lo sabe, puede decirlo en los comentarios [↩]
- No porque dude del nivel intelectual de mis lectores, sino porque dudo de mis capacidades para darme a entender a los demás. [↩]
- El Carbono tiene dos electrones compartidos con un oxígeno y otro que usa para crear una cadena, por lo que solo tiene un electrón “disponible”. [↩]

The [Química Orgánica] V-Compuestos Oxigenados (II) by Roger Balsach, unless otherwise expressly stated, is licensed under a Creative Commons Attribution-Noncommercial-No Derivative Works 2.5 Spain License.




























{ 2 } Comentarios
A mi lo que más me impresiona al leer tus artículos es la capacidad combinatoria de los átomos. Parece como que exploren cualquier posibilidad física de unión. Por ahora hay que ver lo que nos has dicho sólo con C, H y O; y algún halógeno… un infinito de formas químicas. Y cada molécula con sus propiedades específicas supongo, resultado de sus particulares estructuras. Ya sabes que a mi me tira lo del paso espontáneo de la química inorgánica a la orgánica y a los sistemas químicos en “casi equilibrio”… a los sistemas vivos. Pero la verdad es que con cuatro clavos la naturaleza es muy, muy imaginativa.
lo interesante es que los átomos siguen rigurosamente las órdenes de las cuatro fuerzas fundamentales
Escribe un comentario