En el capítulo anterior de esta serie hablamos de un solo átomo en concreto, el hidrógeno. Hoy toca hablar de una columna de la tabla periódica, la primera columna, que podemos llamarla el grupo I, los metales alcalinos.
Antes de ponerme a divagar sobre sus propiedades químicas quiero presentaros sus nombres y sus símbolos químicos: litio (Li), sodio (Na), potasio (K), rubidio (Rb), cesio (Cs) y francio (Fr).
Se han conocido compuestos de estos elementos desde hace muchísimos años, pero los propios metales, como tal, y puros, no se pudieron obtener hasta que no empezaron a surgir métodos electroquímicos. Es muy posible que muchos de vosotros nunca hayáis observado directamente ninguno de estos metales; yo sólo he tenido el placer de ver en directo el sodio.
Voy a hablaros primero de las tendencias generales del grupo para luego hablar un poco de cada elemento.
Tendencias de los metales alcalinos
Situada a la izquierda del todo de la tabla periódica, la primera columna o el primer grupo, el de los metales alcalinos, comprende los primeros átomos de cada periodo, por lo que todos los átomos presentes tienen una configuración electrónica [Gas noble]ns, donde gas noble significa la configuración electrónica del gas noble con Z-1 y n igual al periodo donde se encuentra el metal del que hablamos.
Fijémonos en su configuración ns: tienen un electrón muy incómodo encima de un grupo de electrones perfectamente bien colocados. Está claro que aquí sobra alguien, y si se tiene que largar alguien está claro que será el electrón en el orbital s. Es decir: tiene un potencial de ionización muy bajo.
Dicho de otra manera, todos ellos están muy, muy cerca de ser estables… cosa que significa que en realidad son MUY inestables. Pero antes de meterme con su química, quiero hablaros de propiedades físicas.
Todos los metales alcalinos son metales plateados brillantes a excepción del cesio, que es de un color dorado, y del francio que, bueno, nadie sabe cómo es. Como buenos metales son muy buenos conductores térmicos y eléctricos, pero sus otras características hacen saltar la alarma de cualquier persona que piense en la palabra metal. Todos ellos son muy blandos, más blandos conforme bajamos por el grupo: el litio se puede cortar con un cuchillo sin mucho esfuerzo, el potasio ya directamente se corta como si fuera mantequilla. Además, sus puntos de fusión son bajos, mas bajos conforme más abajo se encuentra el elemento que miremos. Para rematar el asunto todos ellos son muy, muy poco densos. El litio es el menos “exagerado” de todos ellos, como veremos a continuación.
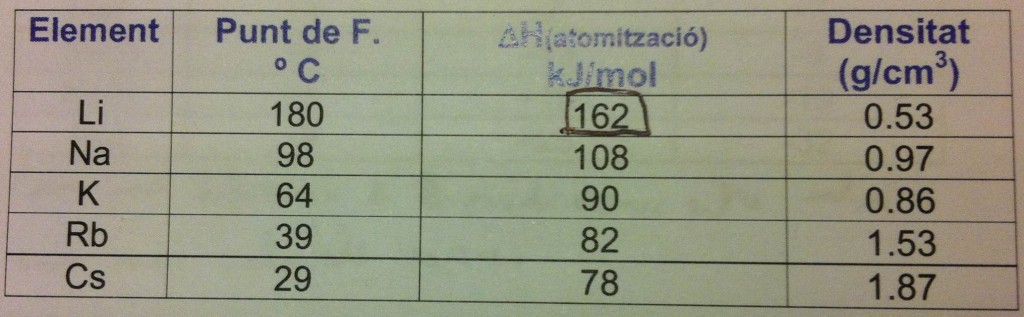
Que los metales alcalinos sean blandos y con ese punto de fusión bajo se explica por su enlace metálico, que es bastante débil, pues en los enlaces metálicos suelen ser los electrones externos los encargados del enlace, y en estos metales solo nos encontramos un electrón por átomo. Añado una tabla sacada de mis apuntes en la que se pueden comparar tres características: punto de fusión, entalpía de atomización y densidad.
La columna del punto de fusión es muy ilustrativa por sí misma. La entalpía de atomización (indicada por ese triangulo y esa H que NO significa hidrógeno, sino entalpía) es la energía que hay que darle a una cantidad concreta de sustancia para que ésta se descomponga en sus átomos separados en forma gaseosa. Simplemente, cuanto mayor, más estable es la sustancia en cuestión. Es fácil ver que las dos primeras columnas son proporcionales, cuanto mayor su entalpía de atomización, mayor es su punto de fusión. La tendencia en ambas columnas no tiene ni una sola irregularidad.
En cuanto a la densidad, no es tan fácil de ver el motivo por el cual se ordenan así, pero es lógico si se piensa un poco; la mejor manera de entenderlo es mirar una tabla periódica y ver la longitud de los periodos a los que pertenece cada uno de los metales. Para empezar tenéis que daros cuenta de lo poco densos que son, pues el agua tiene una densidad de 1 g/cm3, el hierro la tiene de unos 7,87 g/cm3… comparad. El litio es muy, muy poco denso (¡casi la mitad que el agua!), la del sodio es casi el doble de la del litio pero el potasio es ¡menos denso que el sodio! ¿Por qué? Y luego, al pasar de potasio a rubidio la densidad vuelve a subir, pero esta vez ¡casi el doble! En serio, los dos párrafos siguientes son totalmente opcionales y me ha costado lo suyo escribirlos; si no los entendéis… pues saltároslos, que no os pondré exámenes.
Veamos, lo normal sería suponer el incremento de densidad conforme bajamos por la columna, pues cada vez tenemos más protones y neutrones dentro del núcleo, pero si recordáis cuándo os hablé del radio atómico sabréis que éste aumenta cuanto más abajo nos encontramos en la tabla, y además aumentaba de forma relativamente lineal y sin cambios bruscos, y aquí esta el punto del asunto. Resulta que el radio atómico aumenta cada vez un poco, pero entre periodo y periodo no siempre añadimos el mismo numero de protones. ¿Cómorl? Veamos: el litio tiene Z=3, porque el primer periodo sólo tiene dos átomos, el sodio es más denso porque, aun con el incremento de radio atómico, en el periodo del litio, el de encima del propio sodio, ya no hay 2 átomos, ¡hay ocho! Fijaos ahora en que los períodos del sodio y potasio tienen el mismo número de átomos, pero como el radio atómico aumenta, y de forma considerable, todos los protones y neutrones que hemos añadido no son suficientes para siquiera igualar la densidad del sodio.
Que el rubidio de golpe sea mucho más denso es debido a que el período inmediatamente superior a él, el del potasio, en vez de ocho añadimos 18 protones, más del doble que antes, por lo que el radio atómico ha aumentado, pero se ha añadido tanta masa que el conjunto general es más denso. Entre el rubidio y el cesio ocurre lo mismo, sólo que el radio atómico no aumenta mucho, solamente un poco entre ambos, y es por eso que el cesio es más denso aún.
Volviendo a la imagen, quiero señalaros que si os fijáis en el litio (y seguramente habréis observado que en mis tiempos yo lo hice) veréis que es el más estable con diferencia, tiene casi el doble de punto de fusión que el elemento inferior, el sodio, y el cambio de entalpía de atomización es mucho mayor del litio al sodio que no de éste último a los otros.
Sigamos, pero metámosle ya mano a su comportamiento químico.
Los metales alcalinos reciben el nombre de supermetales. Curioso, porque viendo sus características nadie lo diría. Con la información que os he dado de “super“, poco, pues dan risa como metales (vaya, si pensamos en metales como el hierro), pero el nombre les viene de su reactividad, pues cumplen como diccionarios la reactividad general que deberia tener un metal. Como ya dije antes, les sobra un electrón para ser estables, solamente uno, y se lo enchufarán al primero que se les cruce. O el primero que se les cruce se lo robará, como queráis interpretarlo.
Todos ellos tienen que conservarse en líquidos en los que sean inertes, como aceite o queroseno, pues se oxidan con una rapidez pasmosa, y me entenderéis dentro de poco. Los metales alcalinos reaccionan rápidamente con el oxígeno para formar el óxido del metal, pero aún no satisfechos, el propio óxido reacciona con otras cosas, por ejemplo el dióxido de carbono del aire para formar el carbonato del metal.
4Li + O2 -> 2LiO
Li2O + CO2 -> Li2CO3
Os pongo un vídeo del YouTube de 20 segundos muy didáctico en las que podremos ver 4 cosas interesantes. Lo primero y más obvio es ver el aspecto del metal (que realmente no es el metal, sino el metal oxidado), litio en este caso, antes de que lo corten; segundo, que podéis ver lo fácil que se corta; tercero, que una vez es cortado sí podréis ver el litio puro (sin oxidar) del interior que no estaba expuesto al aire, que es reluciente y metálico. Y cuarto, ese aspecto metálico dura apenas unos segundos, fijaos que en seguida desaparece para volverse de un color negruzco (es decir, se está oxidando).
Para hacer las cosas más divertidas (y peligrosas), los metales alcalinos reaccionan con casi todos los no metales de forma violenta, y os pondré un ejemplo que es maravilloso, un metal peligroso reacciona con un gas venenoso que se usó para matar personas en la Primera Guerra Mundial y obtenemos como consecuencia un compuesto que ves, usas y tocas todos los días, y del que necesitas unos gramos diarios para vivir.
2Na + Cl2 -> 2NaCl
NaCl, cloruro de sodio o sal común.
En el vídeo se funde el sodio, porque si no, la reacción es bastante más lenta, además de que no reaccionaría todo.
La reacción más típica de los metales alcalinos es la que tiene lugar entre estos y el agua, pues la cosa se pone interesante. El litio burbujea un poco. El sodio empieza a “corretear” por la superficie del agua mientras burbujea, acabando, normalmente, en una interesante combustión que llega incluso a explosión. Los otros directamente explotan, el cesio es tremendamente rápido en esto. Todos, con el agua, dan lugar, además del hidróxido del metal, a hidrógeno, que con la temperatura de la superficie del metal puede llegar a encenderse, y es el que causa las explosiones.
Fijaos en que flota y en cómo corretea por el agua, curiosísimo. En YouTube podéis encontrar verdaderas animaladas si buscáis un poco.
Pasemos ahora a hablar de las propiedades comunes de los compuestos de los alcalinos.
Los iones de los alcalinos siempre presentan un estado de oxidación +1 (esto es, por cierto, estrictamente mentira, pero cierto para el 99,99% de los casos y nadie, ni siquiera un químico, os mirará mal si lo decís a menos que sea muy pro), es decir, han perdido un electrón, y casi todos los compuestos son sólidos iónicos incoloros o blancos (a menos que le dé color a la sustancia el anión), y a pesar de que son muy electropositivos sus compuestos suelen tener cierto carácter covalente.
Una cosa importante que mencionaré luego es que sus cationes estabilizan aniones, los que se encuentren, cosa que les permite formar compuestos con cualquier anión cosa muy útil. De hecho es posible y común encontrarse con verdaderos carros enormes en forma de anión que se juntan con cationes de metales alcalinos.
Como los compuestos de los alcalinos suelen ser iónicos, es importante que nos fijemos en una característica de estos compuestos: su solubilidad, es decir, cómo de bien se disuelven. Porque, la verdad, cuando hablamos de un compuesto iónico es muy común hablar de sales, pero no todas ellas se disuelven tan bien. Esto sí que os lo tenéis que apuntar: decir que una sustancia no es soluble es peligroso, una sustancia puede disolverse en algo, mucho o poco, aunque sea una cantidad ridícula pero es importante saberlo. Otro artículo para la serie de equilibrio químico, si la hago algún día.
Por ejemplo, pueden disolverse casi 600 gramos de cloruro de litio en 1 litro de agua, mientras que de cloruro de sodio (recuerda, la sal común) sólo podremos disolver unos 36 gramos por litro. Tela, la diferencia.
Como he dicho antes, los cationes se juntan con muchos aniones, y esto en el laboratorio va de perlas, pues cuando necesitas un anión u otro no suelen haber problemas, ya que el catión metálico es muy estable tal cual se encuentra sin que reaccione con nadie, y estos pueden formar sales con cualquier anión que encuentren. La solubilidad de las sustancias es algo muy importante, pues es muy incómodo trabajar con una sustancia que no se quiere disolver. Hace unos años me tocó un experimento que acababa con óxido de manganeso (IV) (leído tal cual, óxido de manganeso cuatro) y casi que aún estoy lavando el maldito matraz.
La solubilidad de estas sustancias dependen principalmente de dos factores: energía reticular y entalpía de hidratación, que favorecen el sólido y la disolución respectivamente… y la verdad, no creo que valga la pena que me meta en el tema, simplemente que sepáis que hay variedad de solubilidad entre sus compuestos, y que se puede explicar por qué es así. Para los más interesados y que sepan algo de termodinámica (pero seguiré sin meterme a fondo), la entalpía de hidratación suele ser baja en los metales alcalinos, por lo que la entropía empieza a asomar su cabeza de forma clara; si recuerdas la fórmula de la energía libre de Gibbs pues ya sabrás que cuando ambos términos, entálpicos y entrópicos, se parecen es cuando se tiene que jugar con la temperatura… y a temperatura ambiente resulta que es la entropía del proceso la culpable de que algunas sales no se disuelvan bien.
Más cosas generales, los colores del fuego. Si, has leído bien, resulta que sus sales, al ser expuestas al fuego, dan lugar a llamas de un color característico único entre ellos, bastante bonitos por cierto. Esto es debido a que la energía de la llama se transfiere a los electrones del metal, los cuales acaban en estados excitados, pero que al regresar a su posición inicial emiten un fotón de longitud de onda perteneciente al espectro de la luz visible.
Muchas otras sales también dan lugar a llamas de colores. Lo interesante de esto es que los alcalinos se pueden identificar inmediatamente según el color de la llama. Todos ellos suelen usarse debido a esto para darle color a los fuegos artificiales.
Características, compuestos y usos de los distintos metales alcalinos.
Tenia pensado dedicarle unos párrafos (muchos, realmente) a cada elemento por separado, pero después de pensarlo y discutirlo al final lo que haré será algo mucho más general y menos profundo para cada elemento, y me centraré más en los elementos más importantes o en compuestos que lo sean. Una de las consecuencias de esto es que hablaré muy poco de algún elemento y de otros bastante más.
Todos los metales alcalinos se encuentran en la naturaleza oxidados, jamás en su forma metálica, es por eso que hasta que no nació la electrolisis no se observaron en su estado metálico. El litio y el sodio se obtienen mediante la electrolisis, pero por debajo de ellos las cosas son más complicadas y, si bien puede seguir usándose para obtenerlos, existen y se usan otros métodos.
El litio tiene el símbolo químico de Li y es junto al hidrógeno, helio y berilio, uno de los elementos que se formaron en parte durante el Big Bang. Su abundancia en el sistema solar es mucho menor de lo que cabría esperar por su masa, pero lo cierto es que su núcleo es bastante poco estable.
Con numero atómico 3, es el primer elemento de la tabla periódica que a temperatura y presión ambientes es sólido, y además menos denso en dichas condiciones. Es un elemento un tanto especial, tanto en la tabla periódica como en los metales alcalinos, cosa que comentaré cuándo hable de los metales alcalinotérreos, ya que se parece a ellos en según que cosas, y que hace que tenga que hablar un poco más de él que del resto. Los otros metales alcalinos siguen bastante la tendencia general.
Como todos los alcalinos, reacciona con el oxígeno del aire, pero es que el litio es uno de los pocos elementos que reaccionan directamente con el nitrógeno, un gas que es muy, muy estable e inerte. Es el único metal alcalino que puede hacer eso, ya que el nitrógeno tiene nada menos que un triple enlace entre los dos átomos muy fuerte, y se requiere de la formación de un producto que haga “merecer la pena” romperlos, aparte de que se forma un ion nitruro (N-) que es poco estable y sólo un ion como el Li+, que es el ion con mayor densidad de carga, puede estabilizarlo.
6Li + N2 -> 2Li3N
Líquido, es una de las sustancias más corrosivas que se conocen, pues se come el vidrio sin ninguna dificultad, además de emitir una interesante luz verdosa. El caso es que el litio es el elemento más reductor de todos, es decir, el que más fácil de oxidar es. Eso implica que es el elemento que libera más energía cuando se oxida, aunque curiosamente es el metal alcalino que menos violentamente reacciona con el agua; esto es fácilmente explicable por su velocidad de reacción, que es la más baja entre los alcalinos.
El litio (en general, no sólo en su forma metálica) se usa para fabricar aleaciones aeroespaciales, baterías, grasas y lubricantes (fijaos bien cuando estéis en una ferretería), como moderador en centrales nucleares, como desecante, para tratar trastornos psicológicos, etc. Además, aparece en compuestos que sirven como combustible para bombas de hidrógeno, contenedores de hidrógeno y otros que sirven para “limpiar” el aire de dióxido de carbono.
2LiOH + CO2 -> Li2CO3 + H2O
Pedro escribió sobre él aquí.
El sodio tiene el símbolo químico Na, y numero atómico 11, es el segundo metal alcalino y el más importante biológicamente, económicamente e industrialmente hablando, y con una diferencia bestial. Es un alcalino de diccionario, y además es el sexto elemento más abundante en la corteza terrestre.
Es también un elemento que necesitamos para vivir, lo adquirimos ingiriendo sal común, NaCl, cloruro de sodio.
Al igual que sus dos vecinos, Pedro ya ha escrito algo de él
Se usa para fabricar lámparas de vapor de sodio, jabón, aleaciones, para extraer metales para reducirlos en su forma metálica, como desecante, como refrigerante en algunas centrales nucleares, en diversas cosas de la industria alimenticia (entre ellos, directamente como alimento), en distintos campos de la óptica o espectroscópicos y en otras muchas cosas. Hace años se usaba en cantidades tremendas para fabricar tetraetilo de plomo.
El potasio tiene el símbolo químico K, numero atómico 19. Su isótopo potasio 40, que es radiactivo, es el culpable de una buena parte de la radiactividad que se genera en nuestra cuerpo. Al igual que el sodio, tiene funciones importantes para la vida e industrialmente es también muy importante.
Compuestos suyos se usan como fertilizantes en grandes cantidades, básicamente casi toda molécula que contenga potasio que se produce en el mundo sirve para ello. Otros usos que tiene son actuar como substituto para la sal, como conservante, como precursor y reactivo de cosas muy variadas (desde ácidos grasos hasta pólvora), incluso de veneno (véase más abajo el cloruro de potasio) y varias cosas que me dejo.
Otro uso parecido al del litio es el de limpiar el aire de dióxido de carbono.
4 KO2 + 2 CO2 -> 2 K2CO3 + 3 O2
K2CO3 + CO2 +H2O -> 2KHCO3
No está nada mal, te limpia el CO2 dos veces y te suelta oxígeno. Se lleva en submarinos y en naves espaciales, pues es mucho mejor que llevar oxígeno además de que resulta muy facil ir quitando el CO2 mediante éste método.
Hasta el momento en que escribo lo que lees, es el ultimo alcalino sobre el que Pedro ha escrito.
El rubidio tiene el símbolo químico Rb y número atómico 37, es un elemento que, pese a no ser poco abundante, se conocen pocas fuentes donde encontrarlo sin problemas, cosa que complica las cosas a la hora de buscarle usos económicos.
Científicamente es bastante estudiado para diversas posibles aplicaciones. Actualmente se usa en electrónica, en medicina para realizar tomografías por emisión de positrones, para hacer relojes atómicos, como componente de placas fotovoltaicas y otras cosas.
El cesio tiene el símbolo químico Cs y su numero atómico es 55, es el último alcalino “normal”, y es el elemento estable menos electronegativo, además de tener el mayor radio atómico de los elementos estables. Es tremendamente reactivo, incluso para ser un metal alcalino, y lo hace a una velocidad que da escalofríos. Simplemente al tocarlo con la mano se fundiría, pues es el metal con el punto de fusión más bajo después del mercurio… si no fuera porque antes de eso, simplemente al reaccionar con la propia humedad de la mano, explotaría.
Es bastante menos abundante que sus compañeros, y se parece químicamente al rubidio. Se usa en electrónica, en distintas cosas para la óptica y espectroscopia, también se hacen relojes atómicos con él, se usa en la industria petrolífera, en la medicina y, por fin, ¡se investigan usos para hacer motores espaciales con él!
El francio tiene el símbolo químico Fr y numero atómico 87, y pese a pertenecer al grupo de los metales alcalinos nadie sabe como es debido a que es MUY radiactivo: su isótopo más estable tiene un periodo de semidesintegración de 22… ¡minutos! En otras palabras, rareza y curiosidad de laboratorio con cero propiedades industriales.
Óxidos: Los metales alcalinos son raros para hacer óxidos, solamente el litio es normal en este caso, su óxido contiene el ion O-2, el ion óxido, que es lo que deberían hacer todos, pero los demás hacen… lo que les da la gana: el sodio da lugar a peróxidos (O2-2), los de debajo dan lugar a sustancias con superóxido (O2-). Todos estos óxidos, no contentos como están, reaccionan con agua para dar hidróxidos, y otras cosas.
Li2O + H2O -> 2LiOH
Na2O2 + 2H2O -> 2NaOH + H2O2
2KO2 + 2H2O -> 2KOH + H2O2 + O2
Tela marinera, con lo normales y parecidos que son para unas cosas, pero otras… El H2O2 es agua oxigenada, peróxido de hidrógeno, que… bueno, ya hablaré de ella cuando toque.
Hidróxidos: Los hidróxidos de los alcalinos son importantes y… peligrosos, ¡cómo no iba a ser así! Son substancias blancas que absorben la humedad bastante rápidamente (cosa que en el laboratorio es una gran complicación), y que en contacto con la piel la atacan, pudiendo producir daños severos según la exposición. Personalmente, he tocado hidróxido de sodio sólido con la mano y bueno, se nota… calorcillo, poca cosa más. En fin, además de lo dicho se tienen que guardar en potes de plástico porque los malditos atacan el cristal (aunque muy lentamente), y en solución tienen la manía de reaccionar con el dióxido de carbono atmosférico. ¡Con lo útiles que son, y las pegas que llegan a tener!
Son muy usados como fuente del ion hidróxido OH- que, bueno, tiene un papelazo mayúsculo en la química, en el que no entraré. El hidróxido de sodio y de potasio se usan muchísimo por su bajo coste.
Hidróxido de sodio: su fórmula es NaOH y tiene una importancia tremenda: es una de las sustancias inorgánicas más producidas en el mundo. Es más, estoy seguro que alguna vez en tu vida lo has visto, seguro que en disolución. Su otro nombre seguro que te suena más: sosa cáustica.
Tiene cientos de aplicaciones, en los laboratorios se usa a toneladas, casi la mitad de la producción mundial (que es de mas de 50 millones de toneladas) y una cuarta parte del total va a parar a la industria del papel. Se usa hasta en casa para limpiar, desatascar tuberías y otras cosas.
Es la base (explicación cutre y rápida: lo contrario a un ácido) más importante de un laboratorio, se usa hasta en la industria alimenticia para tratar aceitunas, patatas, etc. Y con él se hacen pretzels.
Cloruro de sodio: NaCl, de los primeros compuestos que uno aprende a formular ya desde niño, todo el mundo sabe qué es y lo consume. Históricamente tiene un papel tremendo, la sal es una de las primeras cosas que se comercializaron; hasta cuando te pagan a final de mes algo ha tenido que ver, pues tu salario viene de la sal, debido a que a los soldados romanos a veces les pagaban con sal y de ahí sale la palabra. En la Edad Media la Iglesia Católica hasta tenía controladas todas las minas de sal, una fuente tremenda de poder para entonces.
Dado que el agua de mar contiene un 3% de cloruro de sodio disuelto, se produce simplemente evaporando el agua de mar o de enormes depósitos subterráneos que se formaron por evaporación de lagos subterráneos. Es el mineral más consumido con diferencia, mas de 200 millones de toneladas anuales.
Cloruro de potasio: KCl, mucho menos conocido que su hermano, se obtiene igual y se usa como fertilizante pues es, junto con el nitrógeno y el fósforo, indispensable para el correcto crecimiento de las plantas. Se usa también como substituto de sal. A pesar de todo esto, una dosis elevada intravenosa provoca paros cardíacos, cosa que se usa en algunos lugares para… pues para ejecutar a personas mediante inyección letal.
Por supuesto, hay muchos otros compuestos importantes, por ejemplo, el carbonato de sodio y el hidrogencarbonato (o bicarbonato) de sodio, NaCO3 y NaHCO3 respectivamente. El primero se usa para “ablandar” aguas “duras” y el segundo para… hacer pasteles por ejemplo, pues al calentarse liberan CO2 y hace que el alimento tenga una masa esponjosa.
Bien, esta primera columna es, para mi desgracia, la más sencilla de todas, creo yo, ya podéis imaginaros que es difícil saber exactamente de qué hablaros y hasta qué profundidad tengo que meterme. Espero que hayas aprendido cosas nuevas y puedas a partir de ahora, por ejemplo, ver la palabra metal con otros ojos. Estoy seguro de que cuando oigas la palabra alcalina, sodio o algo por el estilo, sepas mejor a qué se refieren.
En el próximo artículo hablaré de los metales alcalinotérreos, un grupo de elementos cercanos a los que hemos hablado, pero que ya empiezan a ser más normales y menos extremistas.
¡Hasta la vista!

The La tabla periódica VI – Los metales alcalinos. by , unless otherwise expressly stated, is licensed under a Creative Commons Attribution-Noncommercial-No Derivative Works 2.5 Spain License.




{ 12 } Comentarios
Muy interesante. Me encanta esta serie
A mi también me ha gustado, sigue así!
Una pregunta: La explicación de las densidades basándose en el balance de peso atómico y radio atómico, ¿es en ese sentido o al contrario? Quiero decir, ¿se conocen los radios atómicos por otras vías y se deduce la densidad, o por el contrario, se conoce la densidad y la explicación basandose en los radios atómicos es una hipótesis que funciona y predice estas densidades?
Por otro lado, ¿cómo se mide la densidad de compuestos tan inestables?
Gracias por la serie! Fantástica!
Hola, gracias por los comentarios.
Argus, los radios atómicos se conocen por distintas vias, de hecho se puede hablar de unos u otros radios atómicos (hablé de ello en el articulo IV de las propiedades). Yo simplemente he relacionado ambas magnitudes para que se vea que claramente lo están. Piensa que la densidad en un metal no solo es función del radio atómico, depende de la estructura cristalina, temperatura… Pero se puede calcular una densidad si se tienen los datos apropiados.
Sobre medir densidades pues ignoro como se hace, la unica vez que he medido densidades fué mediante picnómetros y en cosas muchisimo más corrientes.
Súperinteresante la serie. Te felicito por tu claridad y sencillez a la hora de exponer los conceptos.
Siempre me ha gustado comprender la química y esta serie me dará la oportunidad de aprender.
Lo que me ha llamado siempre la atención han sido los enlaces atómicos, porque muchos de ellos no los puedo comprender por qué son como son.
En esta serie ¿tratarás sobre ellos?
Un saludo.
Gracias por el comentario toms. Enlaces? Uf… complicada está la cosa. Puedo hacerlo de dos maneras, una de ellas seria bien hecha, que es toda la teoria de orbitales moleculares y orbitales hibridos, etc, que bueno, tendria que mirarmelo yo mismo un buen rato antes de verme capaz de hacer un articulo. La otra manera es la cutre que todo el mundo conoce: enlace covalente, ionico y metalico. He hablado ya, por ejemplo del ionico en otros articulos, pero el covalente tiene telita…
Por ejemplo, una manera simple de verlo es que un enlace se puede formar si hay un buen solapamiento entre orbitales atómicos. Por ejemplo, un orbital s se solapa bien con otro s y forma un enlace fuerte llamado σ (sigma), dos orbitales p se solapan medianamente bien y por eso forman enlaces llamados π. Imaginate dos átomos de carbono que se enlazan. Pueden formar un enlace entre sus orbitales s (que será un enlace σ fuerte) y otro enlace entre sus orbitales p (formando un enlace π más débil), teniendo como resultado un doble enlace como el que aparece en el eteno o etileno (C2H4). Pero y en una molecula como el metano (CH4)? Se sabe experimentalmente que tiene una estructura tetraédrica, y eso no deberia ser posible segun la posicion de los orbitales atómicos… y de ahí nació la hibridación de orbitales que, bueno, tiene también su chicha.
Gracias por la respuesta.
La verdad es que tienes razón, el tema de los enlaces tiene “telita”.
Sin tener conocimientos de química he estado leyendo sobre orbitales atómicos híbridos y orbitales moleculares híbridos y, aparentamente, solo aparentemente, lo entiendo, (más o menos), pero cuando entro en casos particulares no entiendo ciertos enlaces y ciertas estructuras lewis.
Por ejemplo: En el HNO3, en N comparte sus 5 e, y si solo tiene 3 desapareados, ¿por qué comparte los otros dos que ya están apareados en un orbital? y si el N puede hacerlo ¿por qué no otros elementos?
¿Por qué algunos elementos que tiene electrones desapareados son radicales y otros no?
Bueno como puedes comprobar son muchas cuestiones que me gustaría comentarlas despacio para aclararlas.
Si las tratas, estupendo, si no, esperaré a mejor ocasión.
Saludos.
Toms, todo lo que tenga que ver con orbitales moleculares y cosas por el estilo la cosa se va de lo que podríamos poner con la etiqueta de simple.
Antes de nada tienes que saber que tener electrones apareados o no no es motivo de que dichos electrones sean o no “reactivos”. Si te lees los articulos de de los grupos 1 y 2 verás que los átomos ahí tienen 1 y 2 electrones respectivamente en un orbital s. Y ambos grupos son muy reactivos. Si que es cierto que algunas configuraciones son más estables que otras por supuesto. Por ejemplo, si que los orbitales llenos dan mucha estabilidad, pero los orbitales la mitad de llenos (como el ejemplo siguiente) también pueden dar cierta estabilidad superior a la normal.
El ejemplo del nitrógeno lo trataré a su debido tiempo en el artículo del grupo 15, pero veamos, hablemos un poco de él. Tiene configuración electrónica de sus electrones más externos 2s2 2p3. En el caso del nitrógeno en conreto dicha configuración es MUY estable, motivo por el cual el nitrógeno gaseoso es tan inerte y se puede “respirar” sin problemas. Ahora, por muy estable que sea, si se le acercan oxígenos con malas intenciones y las condiciones adecuadas (por suerte no son las normales, si no nuestra atmosfera explotaria con una cerilla) habrá reacción. ¿Por que el nitrogeno comparte dos electrones que ya tenia bien colocados? Bueno, más que compartir digamos que lo fuerzan a compartir, y no esos electrones que tenia bien colocados, directamente todos. Y no estaba mejor con todo “bien puesto”? Sin duda alguna. El ácido nitrico, HNO3 que has puesto es MUY oxidante, eso significa que reaccionará con mucha facilidad (y algo de violencia, ya que estamos).
No se si me explico la verdad, en caos negativo lo vuelvo a intentar.
Y sobre radicales pues estas confundiendo las estructuras de lewis con las configuraciones electronicas de los elementos.
Miremos el nitrógeno, oxígeno y flúor. Tienen configuraciones 2s2 2p3, 2s2 2p4 y 2s2 2p5 respectivamente. Según lo que dices tanto el nitrógeno como el cloro son radicales. Si, lo serían… si en la naturaleza aparecieran en sus formas atómicas, cosa que no es cierta. Dichos elementos forman moleculas de nitrógeno, N2, oxígeno, O2 y de fluor, F2. Y estos no son radicales? Para nada. Veamos sus estructuras de lewis: Nitrogeno: http://www.chem.uiuc.edu/clcwebsite/jpeg/N2.jpg Oxígeno: http://www.chemistry.wustl.edu/~edudev/LabTutorials/AirQuality/images/o2Lewis.jpg Fluor: https://classes.lt.unt.edu/Fall_2010/CECS_5030_026/mrp0113/imageswebproject/fluorine%20lewis%20dot%20symbols.jpg
Ahroa ves que no hay electrones desapareados? Cuidado porque los elementos se pueden juntar de diversas formas. Por ejemplo, el azufre peude formar el S8, los metales no forman moleculas, se apelotonan a saco, etc.
Siento mucho haber contestadocon 5 meses de retraso, no me habia dado cuenta. Miraré de no ser tan despistado.
me gustaría informacion mas profunda de los temas a tratar, me gustaría que hablaran de todo lo relacionado con e mismo
Como referencio bibliograficamente la información suministrada por esta página?, gracias.
eres un máquina, me ha encantado, se entiende todo súper bien.
Gracias por la info,lastima que los blogs hoy en día ya no existan casi
Escribe un comentario