En la entrada anterior de esta serie vimos aspectos básicos a tener en cuenta sobre los átomos, aprendimos un poco sobre qué es un elemento y las características que diferencian el átomo de un elemento del de otros. Ahora toca aprender, un poco solamente, sobre cómo surgió, quienes fueron los implicados, etc.
Todo el mundo sabe o ha oído hablar sobre Dimitri Mendeleiev, a quien la historia ha etiquetado como el padre de la tabla periódica, pero lo cierto es que delante y detrás de él han habido muchos otros que han hecho sus trabajos. Muchos lo intentaron y se acercaron más o menos, por no hablar de que hicieron falta trabajos en otros campos para que nuestro químico ruso pudiera hacer lo que hizo. Mi trabajo de hoy consiste en haceros ver el nacimiento de la tabla periódica, pero de forma más expandida. De todos modos, quiero que entendáis que este artículo tiene materia suficiente como para sacar un libro, mucho más que este escueto artículo. Además, del propio Mendeleiev se podría escribir un artículo, era ciertamente un tipo curioso.
Como me imagino que ya suponéis, antes de ponerse a crear una tabla periódica de elementos, hace falta algo mucho más importante: tener algo que ordenar, es decir, se necesitaba descubrir los elementos y estudiarlos. No todos los elementos han sido conocidos desde siempre, muchos elementos han sido descubiertos en apenas dos siglos. Los griegos conocían algunos pese a que no sabían que lo eran, tales como el cobre, la plata, el oro, el hierro y el mercurio. En aquellos tiempos los elementos eran tema de discusiones filosóficas; como los elementos que he citado antes no se sabía que lo fueran, entonces se hablaba de otros elementos, y así se propusieron los típicos cuatro elementos: fuego, tierra, aire, agua. Hay que remarcar que estas ideas de los filósofos griegos o parecidas quedaron inamovibles durante muchísimos años, siglos y siglos, hasta el Renacimiento. Es más, estoy seguro de que si hoy en día hacemos la pregunta “¿qué es un elemento?”, mucha gente citará esos cuatro antes que los elementos químicos. La verdad, miedo me daría saber qué ocurriría si hiciéramos una encuesta a gente al azar.

El alquimista descubriendo el fósforo (o El alquimista en busca de la piedra filosofal) en la que se cree que representa a Hennig Brand, el descubridor del fósforo.
Lo cierto es que pasaron siglos hasta el descubrimiento de un nuevo elemento, hasta el momento en que tuvo lugar el surgimiento de la alquimia, que hizo que se descubrieran muchísimas substancias nuevas. De hecho, en 1669, Hennig Brand se convirtió en la primera persona en descubrir un elemento químico: el fósforo.
El caso es que a finales del siglo XVII apareció Robert Boyle, que, aparte de ser uno de los fundadores de la Royal Society y ser uno de los primeros químicos (pese a que Antoine Lavoisier se lleva el título de “padre de la química moderna”), ya empezó a darle vueltas al asunto de los elementos. La verdad, quién fue el que empezó a distinguir elementos y compuestos es algo discutido, pero no quiero entrar en ello (ni creo que pueda). El caso es que Robert Boyle ya rompió con la idea de los griegos, y definió un elemento como una sustancia que no puede reducirse a una sustancia más simple mediante reacciones químicas, definición que duró muchísimos años y que aún se usa en los colegios en las clases de química… y que yo he usado con vosotros en el artículo anterior.
Avancemos un siglo y nos metemos de lleno en el siglo XVIII, siglo donde se empiezan a descubrir elementos y a saber ya que lo son.
En este siglo se descubren elementos gaseosos y, después de unos cuantos milenios en los que se creía que se habían descubierto todos, nuevos metales. Esta avalancha de descubrimientos se debió en gran parte al desarrollo de la electrolisis. En este siglo entra en escena Antoine Lavoisier, el otro Padre, y con mayúsculas, de la química moderna, y ya hace una lista con los elementos conocidos hasta entonces, 33 elementos… incluyendo la luz y el calor. Algo es algo. En estos tiempos ya se usaba el peso atómico (actualmente, masa atómica) para distinguir unos elementos de otros. Recordad que en esa época no se sabía que existían los isótopos, el átomo ni siquiera se sabía lo que era y había teorías que se desecharon en su tiempo que os harían sonreír, pero, bajo mis ojos, el trabajo de estos caballeros es digno de admiración.
Ya en el siglo XIX nos encontramos con el primer nombre que suele aparecer cuando se habla de los inicios de la tabla periódica, Johann Döbereiner. Éste científico ya empezó a ver que habían ciertas similitudes entre ciertos elementos, de hecho distinguió que existían similitudes entre propiedades en diversos conjuntos de tres elementos. Estos grupos de tres elementos los llamó triadas: una de éstas incluye el cloro, bromo y yodo; otra triada es la del litio, sodio y potasio, que si os fijáis en una tabla periódica moderna veréis que están en la misma columna. Estos tres elementos tienen comportamientos ciertamente parecidos, tanto física como químicamente, y, además, el peso atómico del elemento del medio de cada triada era más o menos la media de los pesos atómicos de los otros dos elementos de la triada. Recordad, peso atómico para ellos, ese peso atómico es nuestra masa atómica.
Casi medio siglo más tarde, a Alexandre-Émile Béguyer de Chancourtois (por supuesto, he copiado y pegado su nombrecito: Alexandre-Émile Béguyer de Chancourtois), el cual era un geólogo y minerálogo, se le ocurrió ordenar los elementos según su peso atómico. Para su desgracia, describió todo el asunto muy “geológicamente” y no puso ningún diagrama en sus escritos, y según me han informado, su editor olvidó incluir un diagrama en lo que publicó, cosa que hizo que su trabajo pasara bastante desapercibido para los químicos de la época.

Organización original de Alexandre-Émile Béguyer de Chancourtois. Pese a que no se puede distinguir mucho, si que se ve la hélice.
Su ordenamiento era bastante elegante. Él mismo describió y nombró la hélice telúrica, y es que los elementos, al estar ordenados de esa manera, daban lugar, si se organizaban en un cilindro, a una bonita hélice en la que los elementos con propiedades parecidas estaban alineados verticalmente. Fue el primer científico en darse cuenta de la periodicidad de los elementos, es decir, el primero en darse cuenta de que los elementos, una vez ordenados en orden creciente de peso atómico, presentaban de manera regular propiedades parecidas, aunque, como he dicho, no fue hasta tiempo después que su trabajo atrajo la atención del resto del planeta, cuando Mendeleiev ya publicó su tabla.
Unos dos años más tarde de la publicación de nuestro amigo francés de corto nombre, John Newlands también se dio cuenta de que si se ordenaban los elementos según el orden creciente de peso atómico, se repetían las propiedades de forma cíclica cada ocho elementos, patrón que llamó ley de las octavas. Cometió un error tremendo, y es que vinculó esto a la escala musical, por lo que fue objeto de burla por muchos químicos, cosa que hizo que le costara muchos años que su trabajo fuera realmente reconocido. Aún así llegó ya a predecir la existencia de algún elemento nuevo, como el germanio.
Estamos ya en 1864, y un químico alemán, Lothar Meyer, hizo lo mismo que los señores antes mencionados, aunque los ordenó según otro criterio, según la valencia (de la que no hablaré ahora), pero su lista no contenía todos los elementos y tampoco despertó gran interés.
Y sí, ahora sí asoman sus barbas, ahora ya aparece el célebre químico ruso Dimitri Mendeleiev, del cual se ha escrito su nombre de todas las formas imaginables. Él, en 1869, ideó lo mismo que Newlands, pero sin vincularlo a la música. El caso es que, meses después de que Mendeleiev publicara su tabla, el alemán de antes, Meyer, publicó independientemente de Mendeleiev una tabla que mejoraba la que ya había publicado él mismo… y era prácticamente idéntica a la del ruso. Aunque ambos recibieron méritos, el propio Meyer reconoció que la idea de Mendeleiev había sido concebida antes que él.
Méritos aparte, veamos la tabla periódica de Mendeleiev.
En esa época se conocían ya 63 elementos y Mendeleiev, como ya muchos químicos, vio las propiedades similares entre elementos, y, por mucho que sea reconocido como uno de los padres de la tabla periódica moderna, es difícil creer que él reconocería el diseño de la tabla periódica actual, pues ha cambiado mucho desde entonces.
Él organizó los elementos en un formato a ocho columnas en orden de masa atómica creciente, aunque también se fijó mucho en la valencia de los elementos. Él mismo se dio cuenta de que faltaban elementos y dejó huecos vacíos para esos elementos que debían encajar en esos lugares. Es más, sugirió que las propiedades de dichos elementos podrían ser predichas según dónde debería estar y sus vecinos.
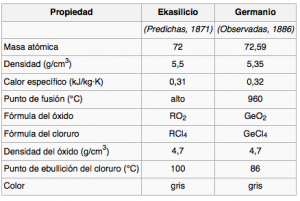
Tabla comparativa entre las propiedades predichas para el ekasilicio y el germanio, descubierto 15 años más tarde.
Por ejemplo, entre el silicio y el estaño dejó un hueco para un elemento por entonces desconocido que llamó ekasilicio. En la tabla de al lado podéis ver una comparativa entre los valores predichos por él y los valores reales más tarde encontrados para el… germanio (nada de ekasilicio, pues). Increíble. Llegó incluso a señalar que algunos pesos atómicos aceptados de otros elementos no eran los debidos, cosa en que parece ser que acertó.
Algunos problemones, y de los gordos, que ya se vieron en la misma época:
-Siguiendo estrictamente el orden de masa atómica creciente, los elementos no siempre encajaban donde deberían. Él invirtió el orden de ciertos elementos a fin de que encajaran. Estas “anomalías” las podéis observar vosotros mismos mirando una tabla, por ejemplo, el níquel tiene mayor Z pero menor peso atómico que el cobalto.
-Algunos elementos recientemente descubiertos para entonces, como el samario y el holmio, ambos radiactivos y pertenecientes al grupo de los lantánidos, no encajaban en ningún sitio, cosa que era bastante embarazosa. El mismísimo hidrógeno tampoco parecía encajar en ningún sitio en concreto… cosa que con dicho elemento persiste actualmente, pero al menos sabemos que no es problema nuestro.
-Algunos elementos del mismo grupo presentaban una reactividad química muy diferente al resto de los del grupo, hecho muy notorio en su primera columna, en la que había metales como el sodio y otros, como el oro, los cuales no se parecían ni en broma.
La tabla en sí actualmente presenta otros defectos no detectados en esa época:
-Para que una columna existiera como tal hacía falta que se conociera al menos uno de sus constituyentes. Por ejemplo, debido a que no se conocía ni un solo gas noble, estos no aparecían en la tabla.
-Trató, por narices, de organizar los elementos en filas repetitivas de ocho, cosa que actualmente se sabe que no es así, por lo que dejó huecos para elementos que eran totalmente erróneos.
-No había lugar para los distintos isótopos.
Ahora bien, pese a estos errores no hay que quitarle mérito alguno a semejante trabajo.
Para que la cosa avanzara más hacían falta conocimientos en otro nivel, se necesitaba saber y comprender la estructura del átomo, no se podía llegar mucho más lejos con los conocimientos de Mendeleiev. Cuando la mecánica cuántica asomó la cabeza y se propusieron distintos modelos atómicos, los problemas con la tabla, de golpe, mejoraron drásticamente.
El caso es que para pasar ya a nuestra tabla periódica hizo falta que apareciera Henry Moseley. Este físico descubrió en 1914 que si se hacía incidir un haz de rayos X en un elemento, los átomos de dicho elemento emiten rayos X de longitud de onda característica de ese elemento.
Básicamente, demostró que esas longitudes de onda se ajustaban a una fórmula que daba un entero específico para cada elemento. Dicho de otra manera, dio a conocer el número atómico (Z) que ya conoces y según el cual se ordenan los elementos en la tabla periódica. Al ordenar los elementos según el número atómico desaparecen las irregularidades de la tabla basada en masas atómicas, y los espacios de los elementos que faltaban quedaban clarísimos. Como curiosidad diré que éste científico acabó luchando en la Primera Guerra Mundial poco después de su descubrimiento, y que murió en alguna trinchera olvidada en 1915 a los 27 años. Una gran y verdadera lástima, pues muchos consideran que habría sido uno de los grandes científicos del siglo.
En los tiempos de Moseley ya se conocían 72 elementos, después de él se sabía exactamente dónde en la tabla se situaban esos elementos y los que faltaban, y era relativamente fácil predecir sus características. Junto al desarrollo de la radiactividad, esos huecos estaban destinados a ser llenados sin muchos problemas.
Casi para acabar, hizo falta la aparición de Glenn. T. Seaborg, que, debido a que le costó bastante aislar el curio y el americio, dedujo que estos dos elementos pertenecían a un nuevo grupo de elementos para explicar sus propiedades químicas, cosa que colegas suyos no creían que debía proponer, pero lo hizo: propuso la serie de los actínidos.
Luego ya se acabaron de descubrir el resto de elementos y… llegamos al presente, donde tenemos una tabla periódica perfectamente desarrollada con 118 elementos descubiertos hasta el momento.

Una de las muchas tablas periódicas que puedes encontrarte por internet. Click para ampliar. Sacada de http://www.acienciasgalilei.com/qui/tablaperiodica0.htm
Ahora que ya sabemos un poco de los átomos y sabéis distinguir un elemento de otro, ya podemos atacar la tabla periódica…
Pues no, lo siento, en el siguiente artículo hablaremos sobre los electrones, que son los dueños y amos de la química: hablaremos de la estructura electrónica de un átomo. Las probabilidades de que me salga un articulo más denso y aburrido son elevadas (aunque personalmente me parece un tema muy interesante), pero si quiero hablar de las propiedades de los átomos sin deciros “esto es así porque lo digo yo” debo meterle mano al asunto, aunque sea un poco.
Nos vemos en el siguiente artículo.

The La tabla periódica II – Historia de la tabla periódica. by , unless otherwise expressly stated, is licensed under a Creative Commons Attribution-Noncommercial-No Derivative Works 2.5 Spain License.







{ 18 } Comentarios
Gran artículo, y por supuesto que gran trabajo de aquellos quimicos.
Solo una duda ¿Como podían predecir -en esa época- el color en las propiedades del ekasilicio?
Saludos
Juan carlos, me imagino que en esa epoca se hizo mediante extrapolacion y comparaciones con los vecinos donde deberia ir porque de electrones no sabian mucho precisamente. Las columnas 1, 2, y de las 13 hacia adelante, son muy parcas en lo que se refiere a colores, es aburrido “colormente”, supongo que mirando a vecinos uno podria pensar en el aspecto de un elemento que faltaba. El germanio, semi metal, tiene de vecinos al paladio, metal blanquinoso, y al arsenico, no metal de color gris…
Vaya, me imagino yo, desgraciadamente de estas cosas no me hablan en la universidad a pesar de que lo encuentro interesantisimo.
Una puntualicación-duda.
Dices que decubrimiento de Moseley permitió clasificar los elementos según Z, pero lo que permitió es clasificarlos según el número de electrones, que no es lo mismo que Z, que es el de protones. Aunque coinciden numéricamente no significan lo mismo. De hecho mi pregunta es, ¿se ordenan así por el número de electrones o por el número de protones? Entiendo que es el de electrones el que determina sus propiedades químicas.
Los elementos se ordenan segun el numero de protones que tengan, y el numero atómico que definí en el artículo anterior es exactamente eso. Los átomos neutros si que tienen igual numero de protones y de electrones pero los átomos sueltos y neutros no suelen encontrarse nunca. Un atomo de un elemento puede ganar, perder, compartir, intercambiar, transferir y robar electrones, que si, que son ellos los que rigen toda la quimica, pero cuando tu hablas del elemento 10 sabes que es el neón. En cambio átomos que tengan 10 electrones pues te encontrarás muchos que pueden tenerlos.
Como veras en unos articulos la tabla periódica tiene la forma que tiene según como están los electrones en los átomos, y queda muy bien ordenada.
Vaya, no se si ha quedado claro o si te he liado, espero que te haya ayudado, si no trataré se intentarlo.
A ver si me explico.
Lo que yo quería decir es que el espectro que emite cada átomo se debe a la excitación de sus electrones. Por lo que los experimentos de Moseley darían como resultado el número de electrones que tuvieran los mismos, no el de protones. Aunque coincidan numéricamente.
La ordenación se basa en el número de protones y esto permite predecir una serie de propiedades. Pero dichas propiedades vienen determinadas por los electrones que tiene el átomo. O para precisar más, un átomo neutro.
Mi pregunta es si las propiedades que se deducen de la ordenación en función de Z se da por el número de electrones del átomo neutro, que, casualmente, coinciden con el número de protones.
He llegado tarde al estreno de tu nuevo post…pero es que en mi pueblo estábamos de feria. Aún resacoso lo he leído del tirón. Sigue así!!!
Lamentablemente de espectroscopia de rayos X aún no me han explicado mucho y menos acerca de los experimentos de Moseley, así que hablare de lo que he podido leer de distintas fuentes.
Al parecer los experimentos de Moseley relacionaban los espectros de emision de rayos X con la carga eléctrica que habia en el nucleo de un átomo. Anteriormente el numero atómico ya se usaba pero no como tal, si no como una enumeración sin significaco físico, y es raíz de estos experimentos que la tiene.
Y vamos ya con tu pregunta. Para empezar quiero remarcar que el numero de protones y electrones sea el mismo en un átomo es de todo menos casual, es obvio que un átomo con una carga eléctrica +2 atraerá 2 electrones. Que sea más o menos fácil que los gane o los pierda es otra historia, pero hasta el metal que se oxida más rápidamente los cogerá si no hay nadie que los quiera (en el artículo de las propiedades periódicas hablaré de esto).
Sobre si las propiedades se deducen del numero de electrones del átomo neutro pues no, el numero de electrones es, efectivamente, importante, pero influyen muchos otros factores. Es mucho más importante saber en que orbitales (siguiente artículo) se encuentran los electrones más externos.
Dicho de otro modo, lo importante a la hora de predecir el comportamiento de un átomo es su configuración electrónica (de la que hablaré en el siguiente artículo). La configuracion electrónica, por supuesto, depende a aus vez del número atómico.
Menudo lio, a ver si ahora te he ayudado, si no pues sigamos carteandonos por aqui xD
Lo de la espectroscopia quizá alguien de por aquí lo tenga más claro y nos pueda sacar de dudas.
En lo referente a los electrones, más o menos me has dado la razón. Lo que yo quería decir es que son los electrones los que determinan las propiedades, no sus protones. En efecto, sí es la configuración electrónica lo que determina las propiedades, pero como los orbitales son fijos y se van llenando según hay más electrones, di por sentado que se me entendería.
Lo de casual, me refería a que en “casual” que los electrones tienen la misma carga que los protones, por eso son el mismo número. Si tuviesen la mitad, los átomos tendrían el doble de electrones y habría que reordenar la tabla, evitando las columnas impares, por lo que habría la mitad de ellas. Por ejemplo, el litio tendría las propiedades del grupo del carbono. Si realmente las propiedades las diera Z, no se movería.
A lo que voy es que se ordenan en función de Z, porque es lo que representa el elemento, que coincide con el número de electrones del átomo sin carga y son estos (su configuración), la que les otorga sus propiedades.
Es por ser puristas, no es que tener 6 protones te haga más o menos reactivo. Tener 6 protones hace que tengas 6 electrones en una determinada configuración y eso te hace ser más reactivo.
Enhorabuena, te está quedando genial la serie, además de que es un tema que me gusta mucho, estoy deseando leer el próximo artículo.
Solo un par de puntualizaciones menores.
1.- Dices que Alexandre-Émile Béguyer de Chancourtois (si, yo también he copypasteado el nombrecito) no incluyó un diagrama de su hélice telúrica en su libro. Según tengo yo entendido (creo que fué en “La búsqueda de los elementos” de Isaac Asimov) fue el editor el que olvidó incluirlo y eso llevó a que poca gente entendiera de que estaba hablando.
2.- Moseley creo que murió en la batalla de Gallípoli.
Y reitero, muchas gracias por estos artículos geniales, me está encantando la serie. Espero con ansia el siguiente capítulo.
A battosay: “los electrones tienen la misma carga que los protones [... ] si tuviesen la mitad” Espera que me pego un tiro! Seria interesante pensar en las consecuencias de esto pero no se yo si podriamos llegar a algo.
Y bueno, nos entendemos en que los electrones son los señores del comportamiento de los átomos, pero sigo pensando que, incluso si los electrones tuvieran la mitad de carga, la tabla periodica seguiria igual, ordenada segun orden creciente de numero atómico que es el numero de protones en el nucleo, como mucho variaria según como fueran los orbitales, que son los que dejan la tabla con su peculiar forma. Da igual que los protones no influyan directamente en las reacciones quimicas, son ellos los que hacen al átomo como es, con que se pierda uno ya no estamos hablando del mismo átomo, su configuracion electrónica se vera modificada, un poco o totalmente por nimio que pueda parecer el cambio. Son los protones los que hacen que los electrones tengan una u otra configuracion, está lleno de metales de transicion que por tener un proton pasan de tener una configuracion “normal” a la tipica anomalia, vease por ejemplo, los s2, los d5 etc, que no deberian serlo.
De todas formas entiendo lo que dices, asi como seguro que tu entiendes lo que digo, pero vaya, es como discutir que cual organo es más importante, si el corazón o el cerebro, puedes decirme veinte mil razones sobre la mayor importancia de uno sobre otro que yo pensaré que sin los dos…
A keme: Tienes razón, lo del geologo frances (lo siento por el de verdad xD) lo tenia que cambiar, pues leí lo que comentas en otra fuente y se me olvidó de modificar, a ver si luego lo edito, gracias por decirlo. Y lo de la batalla de Gallipoli ya fué por no buscarlo, pero nunca está de más ponerlo.
Gracias por los comentarios!
Sí, más o menos nos entendemos.
Con lo de los órganos no estoy de acuerdo, ¿te sabes el chiste de cuando el culo se pone en huelga? XD
bueno sabes me sirvio mucho gracias
Lo primero, gran artículo, creo que es importante que se reconozca el trabajo (y seguro que sienta bien ).
).
Lo segundo, siento reabrir la duda que tenía Battosay pero a mí no me ha quedado del todo clara. Entiendo que Battosay tiene razón cuando dice que la espectroscopía lo que te da es información acerca de los electrones, y que gracias a que tienen la misma carga que los protones, tienen el mismo número de unos que de otros (siempre hablando de átomos neutros). Tenía entendido que los protones dan las propiedades físicas, mientras que los electrones sus propiedades químicas (valencias, etc.). Si esto es cierto, el orden es independiente de los electrones, no así la colocación. Me explico, el número de protones da el puesto que ocupas, mientras que los electrones te dicen la columna que debes ocupar (supongo que más que el número de los electrones será su configuración en los orbitales).
Aunque claro, me meto en la Wiki a ver si he dicho alguna burrada y veo que dice que los protones dan al elemento sus características químicas. Igual el problema está en a qué llamamos propiedades físicas y químicas…
De todas maneras, me ha gustado mucho tu artículo, más que el anterior (imagino que porque ya me lo sabía) y espero con impaciencia a los orbitales !! A ver si me quito una duda que tuve en el instituto y que no he conseguido entender del todo (cuando se saltaba un orbital de la capa 3, creo, y pasaba a uno de la 4, porque era una configuración de menor energía o algo así, también recuerdo un diagrama con lineas oblicuas que había que seguir ¡ pero nadie me decía por qué !
@Dani: Vas con retraso, amigo.
De hecho ya se publicaron dos artículos más de la serie:
El de los orbitales: http://eltamiz.com/elcedazo/2012/10/28/la-tabla-periodica-iii-estructura-elecronica-del-atomo/
Y el de las propiedades de la tabla periódica: http://eltamiz.com/elcedazo/2012/12/02/la-tabla-periodica-iv-propiedades/
Así que ya tienes para leer un buen rato!
Acabo de meterme para ver si alguien me había contestado y he visto “la tabla periódica IV” y digo ¡¿pero no íbamos por el segundo ?! En fin, es que vengo redirigido del artículo del galio del Tamiz, y no se me ha ocurrido mirar la fecha del artículo…
¡Gracias por avisar Mac! (y por molestarte en poner los links )
)
Estoy muy alegre… aprendiendo… GRACIAS.
es genial me ayudo mucho gracias entendi mejor que yo sola
Muy interesante vuestro artículo. Me gusta la química pero también la física. Quería saber si siguen faltando elementos o está completa. Muy agradecido por atenderme
{ 1 } Trackback
[...] hablamos sobre el escandio, y no voy a repetir aquí toda la historia, que también ha sido contada por Álex Girón en El Cedazo. Sin embargo, sí quiero mencionar el caso concreto del galio, ya que fue el primer elemento de la [...]
Escribe un comentario