Bien, por fin vamos a empezar con la química orgánica, después de tres artículos donde he ido introduciendo algunos conceptos: los modelos atómicos, los tipos de enlace y las estructuras de Lewis.
Pero antes de empezar voy a hacer un par de avisos:
- Aún no sé bien cómo estructurar la serie, ya que todo está bastante entrelazado, así que tanto podría hacer doscientos artículos de uno o dos párrafos o bien hacer solamente uno con todo… como ninguna de las dos idea acaba de gustarme del todo, voy a hacer algo entre medias.
- Yo he estudiado en Catalunya así que, si hay algún error de traducción (por ejemplo, veis un butà en lugar de un butano, o un metil en lugar de metilo) pido disculpas y, si me lo decís, lo cambio.
H2:
I2:
NO: éste ya era más difícil ¿verdad? Creo que la dificultad está en ver que el nitrógeno tiene un electrón que no se puede aparear, así que queda como un punto (recordad que las líneas son solo una simplificación de dos puntos).
CHCl3:
Los más perspicaces ya os habréis dado cuenta que estos cuatro últimos ya no son compuestos inorgánicos, son ahora compuestos orgánicos (son compuestos que se forman a partir del carbono).
Y finalmente los tres últimos. Debo deciros que si los habéis resuelto bien, sin tener que pensar mucho, tenéis este artículo más que superado. Si no los habéis sabido hacer no os preocupéis, es muy normal, ya que puede que no se os haya ocurrido poner dobles y triples enlaces, pero vamos con las soluciones:
C2H6:
C2H4:
C2H2:
Eso eran todos los deberes, enhorabuena a los que los habéis hecho (os hayan salido o no).
Bien, pues vamos a empezar. Por si no lo recordáis volveré a poner el esquema de todo lo que vamos a hacer a partir de ahora, es el mismo de la presentación:
- Hidrocarburos
- Saturados
- Cadena abierta
- Cíclicos
- Insaturados
- Cadena abierta
- Cíclicos
- Aromáticos
- Saturados
- Compuestos halogenados (derivados de los hidrocarburos)
- Compuestos oxigenados
- Alcoholes
- Éteres
- Aldehídos
- Cetonas
- Ácidos (carboxílicos)
- Ésteres
- Compuestos nitrogenados
- Aminas
- Amidas
- Nitrilos
Vamos, pues, a empezar con los Hidrocarburos Saturados.
Hidrocarburos Saturados (Cadena abierta)
Vamos primero a explicar qué son los Hidrocarburos. El mismo nombre nos lo indica, son compuestos que están formados ÚNICAMENTE por átomos de los elementos Hidrógeno y Carbono.
Por ejemplo son Hidrocarburos el Metano (CH4), el Etano (C2H6), el Propano (C3H8), el Eteno (C2H4) y el Etino (C2H2), entre muchos más.
Luego… ¿qué son los Hidrocarburos Saturados? Pues son, evidentemente, hidrocarburos, pero que tienen una característica adicional: sus átomos de carbono están unidos por un enlace simple.
Y finalmente lo de cadena abierta[1] es que hay un principio y un fin, es decir, hay un primer átomo y un último átomo (ya veremos luego que no siempre es así).
Para empezar, igual que los hidrocarburos en general, voy a poner algunos ejemplos de hidrocarburos saturados de cadena abierta, si os fijáis bien en los nombres podríais deducir lo que viene en el siguiente párrafo.
Ejemplos: Metano (CH4), Etano (C2H6), Propano (C3H8), Butano (C4H10), Pentano (C5H12), Decano (C10H22) y podría seguir con muchos más.
Bien, ¿veis alguna cosa que os llame la atención?
Correcto, todos tienen la misma terminación, esa es justamente la forma de saber si un compuesto es un Hidrocarburo saturado o no: cualquier hidrocarburo saturado (cadena abierta y cíclicos) termina con el sufijo –ano.[2]
La otra parte es que el lexema de la palabra nos indica justamente cuantos átomos de C tiene ese compuesto.
Así pues vamos a ver las estructuras de algunos hidrocarburos saturados:
| Metano | Met- (1 Carbono) | CH4 |  |
| Etano | Et- (2 Carbonos) | C2H6 |  |
| Propano | Prop- (3 carbonos) | C3H8 |  |
| Butano | But- (4 carbonos) | C4H10 |  |
La manerade formular estos compuestos es simple, solo se tienen que unir los carbonos que deseamos y finalmente añadir Hidrogenos a cada Carbono hasta completar su capa de valencia (que, recordemos, es [He] 2s2 2p2).
Como podéis ver, cada Carbono tiene “asociados” dos Hidrógenos, excepto el primer y último que tienen 3. Así es fácil definir la formula, ya que cualquier hidrocarburo saturado seguirá la ecuación CnH2n+2, así que, si tienes un número dado de Carbonos (llamemos a este número “n”), este compuesto tendrá 2 Hidrógenos para cada Carbono (2n) más otros 2 Hidrógenos, uno al principio y otro al final (2n+2).
Pero esta fórmula, llamada fórmula molecular, no la vamos a usar casi nunca. Una de las características de la química orgánica es que las propiedades de una molécula no dependen sólo del número y el tipo de átomos que tiene, sino de cómo están enlazados los unos con los otros, el tipo de enlace que presentan, etc… Llamamos a este fenómeno isomería: compuestos que tienen la misma fórmula molecular (esto es, la misma cantidad de elementos de cada tipo), pero enlazados de distinta forma. Esto, aunque en menor medida, también ocurre en la química inorgánica, de hecho en 1913 Alfred Werner recibió el Premio Nobel de Química por el descubrimiento de la isomería en los compuestos inorgánicos.
Pues, como decía, la fórmula molecular sólo nos informa del número de átomos que hay de cada elemento distinto. Por lo tanto, solamente con la fórmula molecular no podemos saber qué compuesto es el que tenemos. Por ejemplo, no es lo mismo tener una molécula de Butano (C4H10) que una de Metilpropano (C4H10).
Pero lo que sí que nos sirve para este propósito es la fórmula desarrollada (que hasta ahora no había dicho que se llamara así, pero ya la había puesto muchas veces, pues es como se denomina la fórmula con la que hacemos las estructuras de Lewis en química orgánica). Así pues tendríamos el Butano:
Y el Metilpropano:
El problema de la fórmula desarrollada es que es muy pesada de hacer. Ahora, porque son compuestos de 14 átomos, pero ¿os imagináis tener que dibujar el Decano?[3]
Así que los químicos tuvieron que inventar una manera de escribir los compuestos que, sin perder la información de cómo están enlazados los átomos, fuera más fácil y rápida de escribir. Y lo consiguieron (bueno, sigue siendo algo pesado dibujar un decano, pero ni punto de comparación con la forma desarrollada). A la nueva fórmula, se le denominó, ¿cómo no?, fórmula semidesarrollada, donde se eliminaban todos los enlaces que no nos interesan (de hecho los únicos que nos interesan son el tipo de enlace que une cada Carbono, y a qué Carbono se unen los otros átomos). Vamos a ver algunos ejemplos que ya hemos visto antes en sus fórmulas desarrollada y molecular, pero ahora en la fórmula semidesarrollada.
Metano → CH4
Etano → CH3-CH3 (aunque se puede girar el orden y escribir H3C-CH3)
Propano → H3C-CH2-CH3
Igual con el butano → H3C-CH2-CH2-CH3
Hago una tabla con las diferentes formulaciones (las que hemos visto y otras que no hemos visto, pero que existen y son comunes), para que veáis las diferencias (a veces sutiles) entre ellas. Aquí tenéis distintas formas de formular un mismo compuesto (que aún no sabemos formular, pero tampoco nos interesa)
Hidrocarburos Saturados (Cíclicos)
Bien, vamos ahora a explicar lo que son los Hidrocarburos Saturados Cíclicos (por el nombre ya podéis imaginar más o menos lo que son). Si habéis entendido hasta ahora no os supondrá dificultad alguna entender esto. Básicamente son Hidrocarburos Saturados, pero en los que el primer Carbono y el último están unidos entre ellos, así:
Vamos a ver como se llama este compuesto. Utilicemos la lógica y lo aprendido hasta ahora:
-¿Cuántos átomos de Carbono tiene la molécula?
5, correcto, así que su lexema es “penta”.
-Ahora, ¿Qué elementos están presentes en la molécula?
Sólo el Carbono y el Hidrógeno, por lo tanto es un Hidrocarburo.
-¿De qué tipo son sus enlaces?
Todos ellos son enlaces simples, por lo tanto es un Hidrocarburo Saturado, ergo su sufijo va a ser “-ano”.
Por ahora tenemos Pentano, pero el Pentano, al igual que el Metano, el Etano, el Propano, el Butano, etc… no es cíclico. Por lo tanto debemos añadir un prefijo, ya que no puede ser que dos moléculas totalmente distintas tengan el mismo nombre, así que añadimos el prefijo Ciclo-
Así que ahora ya sabemos cómo se llama nuestra molécula. Si antes teníamos Pentano y tenemos que añadir el prefijo “ciclo-“ nos queda Ciclopentano. Pues justamente así es como se llama.
Ahora voy a hacer una pequeña pausa. Les voy a presentar el programa que usaré para dibujar las moléculas a partir de ahora[4]. Éste es el mejor que he encontrado, pero hay una cosa que no me gusta: no me permite dejar la fórmula semidesarrollada; bueno, sí me permite pero no me gusta nada, porque queda marcado con un color verde y queda muy mal, así se ve el Ciclopentano con su fórmula semidesarrollada con este programa:
El programa me deja todos los compuestos en su forma simplificada (que he mostrado antes en el cuadro), la forma simplificada básicamente consiste en eliminar todos los símbolos de los elementos, y representar los carbonos como un vértice entre las dos líneas que representan el tipo de enlace. (Bueno, técnicamente el programa usa una formulación mixta entre simplificada y semidesarrollada, pero mayormente simplificada)
En el caso de los cíclicos, claro, al no haber ni primero ni último se quitan todos, quedando simplemente un pentágono, en el que, en cada vértice hay un carbono con sus hidrógenos correspondientes:
Así que a partir de ahora vamos a usar siempre esta última fórmula.
Hidrocarburos Saturados (Ramificaciones)
Antes de explicar las ramificaciones tengo que introducir otra cosa, los radicales (los radicales alquilo, concretamente).
Los radicales no tienen ningún secreto, se obtienen a partir de un Alcano (Alcano es otro nombre que reciben los Hidrocarburos Saturados), al cual se le quita un Hidrógeno (normalmente en el primer o último carbono, pero veremos alguna excepción). Para nombrarlos solo tenemos que modificar el sufijo -ano por el sufijo -ilo (el lexema, que recordemos nos dice el número de carbonos, no se debe tocar).
| CH3- | Radical Metilo |
| CH3-CH2- | Radical Etilo |
| CH3-CH2-CH2-CH2- | Radical Butilo |
Bien, ahora vamos a explicar la última parte de este artículo, las ramificaciones. Puede que algunos ya os hagáis percatado de que hay cosas que no hemos aprendido aún a nombrar, por ejemplo:[5]
Bien, ¿cómo podemos nombrar esto? Algunos puede que penséis, que, como tenemos 6 Carbonos, éste puede ser un Hexano. Esto no es así (aunque los dos sean C6H14), ya que recordemos que depende de cómo estén unidos los átomos la molécula tendrá unas propiedades u otras, en este caso lo que hay es justamente una ramificación.
No debería ser muy dificil ver que una ramificación es justamente un radical unido a un carbono EN LUGAR DE UN HIDRÓGENO.
Vamos a ver cuál es el esquema a seguir para nombrar los compuestos (nos centraremos por ahora en los H. Insaturados):
| Localizador (1,2,3…) | + | Nombre del radical | + | Prefijo (met, et …) | + | ano |
Vale, hay algunos conceptos de este esquema que aún no he explicado, y aunque pueden ser intuitivos, voy a hacer una pequeña explicación.
Localizador:
Es el número de Carbono donde se encuentra el radical que deseamos localizar, más tarde hablaré de cómo se deben numerar correctamente los Carbonos.
Nombre del radical:
Se trata de nombrar el radical en cuestión, ya he enseñado cómo unos párrafos más arriba, sólo se diferencia en que el radical pierde la última -o (en lugar de metilo, metil-; etilo, etil- etc…)
Prefijo:
Aquí es donde debo detenerme más tiempo, no sólo porque aún no sepáis cómo se hace (ya que yo no lo he explicado) sino porque parece muy fácil, y es donde más tiempo deberéis dedicar cuando queráis nombrar un compuesto ramificado. Bueno el concepto básico, como he dicho, es muy fácil: el compuesto ramificado se trata de un radical unido a un Alcano.
Pero lo difícil viene cuando debes diferenciar entre la ramificación y el Alcano (llamados cadena ramificada y cadena principal). En el último ejemplo podemos ver que hay un metilo unido a un pentano, pero también podemos ver que hay un Etilo unido a un Butano. ¿Cómo nombramos al compuesto?
Bien, por esto es importante saber ver la cadena principal (generalmente hablaré de “escoger” la cadena principal, pero en realidad no escogeremos nada, solamente hay una posibilidad correcta). Para localizar y numerar la cadena principal debemos seguir estas normas:
- Es la cadena más larga
- Es la que tiene más ramificaciones
- Se numera por el extremo que deja los localizadores lo más bajos posible
De manera que, siguiendo las normas que acabo de anunciar, ya podemos saber cómo nombrar el compuesto anterior:
La cadena principal será la de Pentano, por lo tanto tendrá un radical metilo en el localizador número 3 (independientemente de cualquier numeración. Así que su nombre es:
3-Metilpentano
Aunque aún no hemos visto nada con dos radicales, voy ya a avisaros de la última norma que debéis tener en cuenta antes de nombrar compuestos: los localizadores siempre se separan con una coma (,) mientras que para separar el localizador de el nombre (ya sea del radical o de la cadena) se usa un guión (-).
Aquí podéis ver una forma más visual de hacerlo:
El primer paso (la cadena principal) está marcada en rojo, los localizadores en naranja y la ramificación en azul.
Ahora vamos a hacer unos ejemplos más para que os familiariceis más con el protocolo y añadiré nuevas normas que deberéis tener en cuenta.
Vamos a ver qué es lo que pasa, por ejemplo, si tenemos dos radicales (así es como se llaman las ramificaciones) iguales:
Saludad a vuestro nuevo amigo –no sin antes analizarlo a fondo, claro-:
Bien, esta vez lo que haré será, primero, modificar este compuesto para que podáis verlo mejor (lo pondré en formula semidesarrollada) e iré poniendo imágenes para que podáis ver todos los pasos que hay que seguir:
Formula semidesarrollada:
Bien, ¿recordáis cual era el primer paso? Sí, efectivamente, escoger la cadena principal. Vamos a ver distintas opciones:
Aquí vemos (o no, porque es bastante caótico) seis posibles cadenas. Vamos a mirarlas todas:
- Cadena rojo oscuro: 3 átomos de Carbono
- Cadena rojo claro: 5 átomos de Carbono
- Cadena naranja: 4 átomos de Carbono
- Cadena amarilla: 5 átomos de Carbono
- Cadena verde: 4 átomos de Carbono
- Cadena azul: 4 átomos de Carbono
Como vemos hay dos cadenas con 5 átomos de Carbono, la “rojo claro” y la amarilla, ¿cómo sabemos cuál debemos elegir? Pues pasamos al siguiente paso: Numeramos las dos cadenas y escogemos la que tenga los radicales en el localizador más bajo posible. Nos quedan estas opciones –elimino todas las cadenas excepto la rojo claro y la amarilla-:
Vemos que hay 4 numeraciones posibles, analicémoslas al igual que hicimos con las cadenas:
- Rojo oscuro: Tiene los radicales en los números 3 y 4
- Rojo claro: Tiene los radicales en los números 2 y 3
- Naranja: Tiene los radicales en los números 2 y 3
- Amarillo: Tiene los radicales en los números 3 y 4
Y otra vez vemos que hay un empate entre la numeración rojo claro y la numeración naranja…
Llegados a este punto, vemos que ya no hay ninguna norma que nos diga cuál de las cadenas debemos escoger como principal. Esto quiere decir que ya nos da igual lo que escojas, de hecho, tanto la numeración rojo claro como la naranja son equivalentes y darán el mismo nombre. Como la numeración más intuitiva es la rojo claro, voy a utilizar la naranja –sí, ésta es mi lógica-
En el tercer paso vamos a identificar los radicales; yo creo que están muy claros ¿no?
Marcados en azul vemos los radicales, en ambos casos podemos ver que se trata del mismo, y justo el mismo que habíamos visto antes, el metilo.
Bien, pues ahora tenemos todas las informaciones y ya podemos poner los nombres; recordad el orden:
- Localizadores: antes, como sólo había uno, poníamos ése y ya está, pero ahora tenemos que poner todos los localizadores (de menor a mayor) separados con comas, por lo tanto [2,3].
- Separado por un guión el nombre y el número (ojo, número de radicales, no localizador) del/de los radical/es (sin la –o). Vamos a ver nuestro ejemplo: tenemos sólo dos radicales y ambos son metilo (para abreviar diré que tenemos 2 x metilo), por lo tanto, tenemos que dar esta información en forma de prefijo y, como sólo tenemos dos, en lugar de escribir [2,3-metil] tenemos que escribir [2,3-dimetil].[6]
- Por último, poner el nombre de la cadena principal, en nuestro caso otra vez pentano; así que nuestro compuesto es:
2,3-Dimetilpentano
Vamos a hacer el último todos juntos y ya termino el artículo. Vamos a ver ahora qué pasa si tenemos más de un radical… pero no son del mismo tipo (y así de paso presentaros a otros radicales, que el metilo no es el único de ellos, hay un montón).
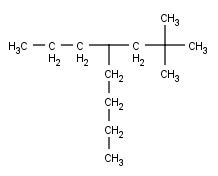
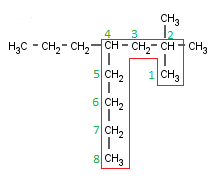
Vamos a nombrar este compuesto:
Localizamos su cadena principal. Esta vez dejo que la busques tú, intenta hacer lo que he hecho yo antes, así verás todas las opciones:
…
…
…
…
…
…
…
No, de verdad, no bajes hasta que no lo hayas hecho, que si no, no aprendes
…
…
…
…
…
…
…
Bien, si has llegado hasta aquí y no lo has hecho, allá tú…
Este compuesto tiene, otra vez tres cadenas de la misma longitud, pero, aunque lo mejor es analizar todos los localizadores (incluso a mí a veces se me escapa alguna opción por querer ir demasiado rápido) aquí puedo deciros que otra vez las tres son equivalentes, así que cogeremos una de las tres, la que queramos (si coges una distinta a la mía, y sigues todos los pasos sin equivocarte, verás que te sale el mismo nombre).
Ahora numeramos, y aquí también te dejo que lo hagas tú, que además ésta es muy fácil de numerar.
…
…
…
…
…
Ésta es la numeración óptima para mi cadena; si has elegido alguna de las otras tres debe ser igual, excepto el número 1, que debe estar en algún otro carbono.
Ahora vamos a identificar los radicales. Primero, como siempre, los marcaré en azul y luego los nombraremos:
Vamos primero a los fáciles. Los de la derecha son dos metilos, que ya hemos visto varias veces, pero el radical de la izquierda es nuevo (aunque, si recuerdas lo que he dicho antes –y si no, vuelve a leer más arriba- será muy fácil nombrar el radical). El radical tiene tres átomos de Carbono, así que, igual que la molécula de tres átomos era el propano, este radical será el propilo. Así que tenemos dos metilos y un propilo: ya tenemos toda la molécula analizada, así que podemos empezar ya a poner los nombres -contened la emoción-.
Ahora nuestro orden preestablecido ya no nos sirve, porque ése es sólo el orden que debemos seguir en algunos casos particulares (cuando solamente tenemos un tipo de radical). En el caso de que tengamos dos radicales diferentes (como podría ser el caso de tener dos metilos y un propilo) se tiene que seguir el siguiente orden:
- Ordenas los radicales por ORDEN ALFABÉTICO (cosa que nunca he entendido, porque seguramente habrá alguna que otra discrepancia entre idiomas… pero bueno, algún motivo tendrá). En nuestro caso, claramente primero el metilo y luego el propilo
- Escribes los localizadores del primer radical (metilo): [2,2]
- Separado por un guión, escribes el número y el tipo del primer radical (2 x metilo): [2,2-dimetil]
- Separado por un guión[7] escribes los localizadores del segundo radical: [2,2-dimetil-4]
- Separado por un guión escribes el número y el tipo del segundo radical (1 x propilo): [2,2-dimetil-4-propil]
- Escribes el nombre de la cadena principal (8 x Carbonos): octano
Y el nombre de nuestro compuesto eeeeess…
(Redoble de tambores)
2,2-Dimetil-4-propiloctano
Señoras y señores… hasta aquí el artículo (a lo tonto, a lo tonto, ha llegado a las 3500 palabras) y, por cierto, si el nombre de 2,2-dimetil-4-propiloctano os parece largo, raro y complicado… esperad a ver lo que sigue…
Pero no os dejaré marchar antes sin algunos deberes, fácil, solamente tenéis que nombrar los siguientes compuestos:
Sólo tres, las tres asequibles si se ha entendido todo el artículo, aunque la tercera no la hayamos explicado aquí y a lo mejor necesites tener un golpe de inspiración para hacerla bien.
- También llamados, aunque raramente, acíclicos por razones que veremos más adelante [↩]
- Quiero hacer énfasis en que los nombres los hemos puesto los humanos, así que los sufijos no son más que una norma mnemotécnica. [↩]
- C10H22 por si no te acuerdas. [↩]
- Se llama MarvinSketch, y excepto alguna que otra cosa va muy bien, y además te permite visualizar estructuras en 3D y muchas funciones. [↩]
- Voy a utilizar la fórmula semidesarrollada unas veces más hasta que os acostumbréis completamente a la simplificada. [↩]
- ¡Ojo!, uno de los errores más comunes es olvidarse este di-, dando por supuesto que, al poner dos localizadores ya estás indicando que hay dos. ¡Mucho cuidado con esto! [↩]
- Recordad que los localizadores se separan con una coma, mientras que para separar un nombre y un localizador se usa el guión. [↩]

The [Química Orgánica] I-Hidrocarburos saturados by Roger Balsach, unless otherwise expressly stated, is licensed under a Creative Commons Attribution-Noncommercial-No Derivative Works 2.5 Spain License.































{ 2 } Comentarios
Muy bueno Roger. Muy clarito y con posibilidades de aprender jugando sorteando las trampas. Supongo que aún estamos en lo fácil, je, je…
Creo que hay una errata en el apartado “Prefijo” 2º párrafo: hay un “Etino” que creo debe ser “etilo”.
Un saludo y hasta la próxima
Jaja, pues si, toda la razón, es un etilo no etino
Por otra parte, estamos en lo fácil porque solo hemos visto una posibilidad, y más adelante veremos muchas más y va a ser difícil el hecho de memorizar todo lo necesario y tenerlo siempre presente. Pero en este artículo es donde se aprenden los aspectos más básicos y por eso, probablemente uno de los más difíciles (o el más difícil) de comprender.
Roger
Escribe un comentario