Hola a todos. Han pasados unos cuantos meses desde el último artículo de esta serie en el que os hablé de los metales alcalinos, pero aquí estoy de nuevo, dispuesto a seguir atacando la tabla periódica.
Iré hablando de cosas que ya he tratado en artículos anteriores y, si bien trataré siempre de ser lo más claro posible, os recomiendo que si no os los habéis leído, lo hagáis. O que me preguntéis, que nunca está de más.
Esta vez nos toca saltar al siguiente grupo de la tabla periódica, el 2, y esto nos sitúa en la posición de los metales alcalinotérreos. Como ya os habréis dado cuenta, el propio nombre de estos elementos contiene la palabra alcalino, cosa que ya indica por dónde irán los tiros sobre su reactividad y tal. El nombre, por cierto, es debido a que son bastante abundantes en la corteza terrestre.
Aunque a priori el nombre “alcalinotérreo” os pueda sonar a chino, si repasáis sus componentes veréis que algunos de ellos os suenan: el berilio (Be), el magnesio (Mg), el calcio (Ca), el estroncio (Sr), el bario (Ba) y el radio (Ra).
En el momento en el que escribo esto Pedro ha hablado ya de tres de ellos, pero yo os hablaré del grupo en general, sus características generales y alguna poca cosa de cada uno de ellos, más algunos compuestos interesantes en que participan.
Tendencias de los metales alcalinotérreos
Nos encontramos en la columna a la derecha de los metales alcalinos, y todos los elementos de este grupo tienen un protón más que sus compañeros de la izquierda, que como recordareis, tenían todos una configuración electrónica [Gas noble]ns (y reitero, gas noble significa la configuración electrónica del gas noble con Z-1 y n igual al periodo donde se encuentra el elemento del que hablamos), por lo que los elementos que trataremos tienen una configuración [Gas noble]ns2.
Podríamos pensar que, siendo la configuración electrónica de los metales alcalinos poco estable, al añadirle un solo electrón las cosas no cambiarán mucho. Y mucho-mucho, no nos equivocaríamos, la verdad. Pero esta vez nuestros electrones han ocupado totalmente un orbital, el s, cosa que da cierta estabilidad extra en algunos casos. Digo todo esto, pero aquí la película se repite un poco aunque, digamos, que de forma menos extrema. Los metales alcalinotérreos son casi estables, pues si pierden dos electrones tendrán una configuración bien estable. De hecho iré comparando los elementos de ambos grupos para que sea más fácil hacerse una idea de lo que digo.
Tengo que advertir algo: aquí me encuentro con cosas que ya no puedo simplemente generalizar a saco y quedarme tan ancho: el berilio, por mucho que pertenezca a este grupo, no lo podré tratar de la misma manera, y el radio, como su hermano alcalino, es muy radiactivo. Dicho de otro modo, a menos que indique lo contrario, las generalidades de los metales alcalinotérreos estarán referidas para todos los elementos del grupo 2 MENOS el berilio y el radio. Y la verdad, el magnesio hace también cosas un poco raras, pero sí que entra en lo general del grupo.
Los metales alcalinotérreos tienen un aspecto más bien común, son metales plateados o blanquecinos (no, el calcio no es blanco). De todos modos, seguimos un poco lejos de la idea general de “metal” que todos tenemos en la cabeza, como veremos a continuación.
El que los metales alcalinotérreos tengan dos electrones externos que participen en el enlace metálico se nota: son más duros, menos reactivos, más densos, y funden a temperaturas mayores que sus compañeros alcalinos.
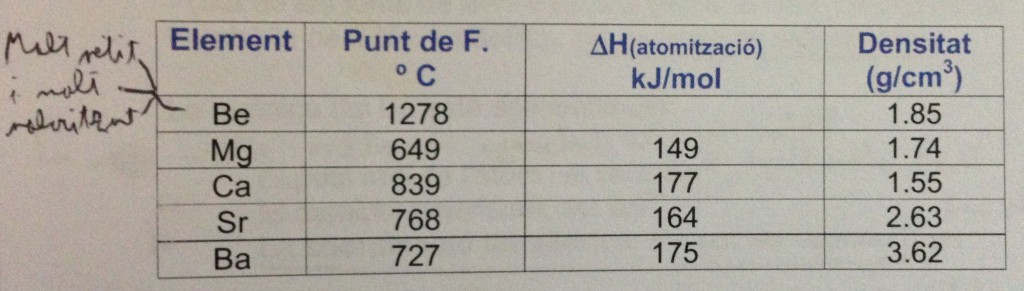
Como podéis observar en la imagen sacada de mis apuntes, mi letra da asco. Y además podréis observar la tendencia de tres características: punto de fusión, entalpía de atomización y densidad.
Sería buena idea que comparáseis el cuadro con el que puse en el de los metales alcalinos.
En este grupo de la tabla periódica las cosas ya no son tan fáciles y simples. En el punto de fusión, que debería disminuir conforme más abajo se encuentra el elemento, aquí ya encontramos discrepancias: el que está más arriba, el magnesio, es el que lo tiene más bajo, y los tres restantes ya siguen la tendencia normal.
La entalpía de atomización, que en el último artículo seguía exactamente la misma tendencia que el punto de fusión, aquí tiene alguna discrepancia, pero tampoco es algo alarmante.
Digo todo esto, pero vuelvo a pediros que comparéis la tabla de las dos columnas para que os deis cuenta de que tanto los puntos de fusión como la entalpía de atomización varían realmente muy poco dentro del grupo. Dicho de otro modo, los metales alcalinotérreos se parecen bastante entre sí, al menos en lo que se refiere a sus propiedades físicas.
La densidad sí que sigue exactamente el mismo patrón que en la columna anterior, sólo que los metales alcalinotérreos son más densos que los alcalinos del mismo periodo.
Como ésta serie es de química, hablemos de química.
Los metales alcalinotérreos tienen un comportamiento parecido a los alcalinos, pero sin llegar a sus extremos. Su reactividad, por cierto, va de menos a más al bajar por el grupo. Por ejemplo, el calcio, el estroncio y el bario reaccionan con agua fría, pero el bario es el que lo hace más vigorosamente:
Ba + 2H2O –> Ba(OH)2 + H2
El magnesio no reacciona en absoluto con agua fría, pero sí que reacciona lentamente con agua caliente, dando su hidróxido correspondiente e hidrógeno.
Todos estos metales, además, reaccionan con muchos no metales, por ejemplo con el cloro para formar cloruros.
Ca + Cl2 –> CaCl2
Hay que destacar que los metales alcalinotérreos, cuando están calientes, son capaces de reaccionar rápidamente con el nitrógeno de la atmósfera, un gas muy inerte:
3Mg + N2 –> Mg3N2
Vamos ahora a atacar los compuestos de este grupo.
Todos los elementos del grupo (todos) tienen dos electrones externos que “sobran”, por lo que el estado de oxidación que acostumbrarán a tener a menos que sea en su forma elemental es +2, es decir, formarán iones M2+. De hecho, casi todos sus compuestos serán compuestos iónicos. Y digo casi todos porque el magnesio forma compuestos covalentes, y el berilio tiene más comportamiento covalente que no otra cosa.
La mayor parte de los compuestos del grupo son sólidos iónicos estables e incoloros o blancos, siempre que no haya un contraión que le dé un color distinto.
Las sales de estos metales suelen estar hidratadas, o sea, además de los átomos que forman la sal suelen tener moléculas de agua “pegadas”. Por ejemplo, el cloruro de calcio puede ser anhidro, monohidratado, dihidratado, tetrahidratado o hexahidratado. Esto se suele indicar añadiendo un punto después de la formula de la sal y un numero delante de H2O. Por ejemplo, el cloruro de magnesio hexahidratado es MgCl2·6H2O. De hecho, muchas de estas sales tienden a hidratarse, es decir, si pones una sal anhidra con agua la sal se quedará con las moléculas de agua que más estable la dejen.
A diferencia de las sales de los alcalinos, que solían ser solubles, aquí nos encontramos justo lo contrario, muchas son insolubles (o mejor dicho, poco solubles). La verdad es que la solubilidad de todos estos compuestos es una bonita pesadilla, así que diré cuatro cosillas para que os hagáis una idea. Las sales con aniones monocargados, como los cloruros y nitratos, suelen ser solubles; los que tienen más de una carga suelen ser insolubles, pero no obstante los sulfatos, que tienen doble carga negativa, pasan de solubles a insolubles conforme se baja en el grupo.
Aquellos que sepáis algo de termodinámica, leed lo siguiente; los que no, podéis saltaroslo.
Al igual que con los metales alcalinos, los términos entrópicos y entálpicos se parecen bastante, y esto da problemas; no obstante, los valores son mucho mayores en comparación de los de los alcalinos. Por ejemplo, si se tira cloruro de calcio anhidro en agua, el proceso de disolución es exotérmico y calienta el agua de forma bastante apreciable. A veces, los papeles se invierten, por ejemplo, los factores entrópicos son los que favorecen que el cloruro de sodio sea soluble, pero en cambio en el cloruro de magnesio no lo favorecen. El caso es que hablamos de factores energéticos relativamente altos, que numéricamente se diferencian muy poco entre sí.
El que algunas sales sean insolubles, se hidraten fácilmente y sean estables se puede aprovechar para secar el agua de un medio en el que no la queramos de manera muy fácil y simple.
Hay que destacar algo importante: su radio iónico. Veréis, los radios ionicos de los alcalinotérreos son menores que los de los alcalinos del mismo periodo… pero es que ¡los alcalinotérreos tienen el doble de carga! “¿Y qué?” os preguntaréis. Pues veréis, la relación carga/radio del ion es una medida del “poder polarizante”, es decir, la capacidad que tiene el ion de alterar los orbitales de un átomo que tiene cerca.
Dicho de otro modo, los iones de este grupo son muy pequeños (menores cuanto más arriba del grupo) y además tienen una carga relativamente grande, por lo que la carga está muy concentrada. Esto, que puede parecer una tontería, no lo es en absoluto, pues explica que hayan o no hayan algunas sales de estos elementos, la hidratación de sus sales y el parecido entre algunos elementos de grupos distintos como el litio y el magnesio, por un lado, y el berilio y el aluminio, por otro (recordáis que os dije que el litio se separaba del resto de metales alcalinos? Aquí encontramos algunos parecidos).
Y bueno, hablemos un poco de cada elemento.
Características, compuestos y usos de los distintos metales alcalinotérreos.
El berilio es raro y caro. En su forma elemental es de color gris, es duro, tiene alta temperatura de fusión, baja densidad, elevada conductividad eléctrica… Por raro que sea en su grupo, es un metal.
Como todos los metales de las dos primeras columnas, no se obtuvo en su forma metálica hasta que se descubrió la electrolisis. El berilio se encuentra en diversos minerales, pero sigue siendo poco común, por lo que pese a tener aplicaciones útiles y otras más en las que es insustituible, es un elemento poco importante.
Como he comentado, su comportamiento dista bastante de sus compañeros de grupo, pues el enlace covalente predomina en su química. El átomo del berilio es muy pequeño y su ion además es muy polarizante, lo suficiente como para polarizar cualquier anión que se le acerque. De hecho, sus compuestos iónicos no son como aquellos de los que he hablado, sino que suelen tener el ion [Be(OH2)4]2+.
Además, expuesto al aire su oxidación es muy lenta, cosa muy interesante para un metal.
Otra cosa que lo hace muy distinto a casi todos los metales es que puede formar especies oxoaniónicas. ¡¿Qué?! Veamos, los metales suelen reaccionar con los ácidos pero no con las bases, creo que éste es un hecho bastante conocido. Recordad que una base es, hasta que haga una serie para explicarlo, el contrario de un ácido, y un ejemplo es el hidróxido de sodio del que hablé en el artículo de los metales alcalinos. Pues bien, el berilio, junto a sus dos amigotes zinc y aluminio, sí que pueden reaccionar con bases, y se les llama anfóteros. Además, a estos metales se les suele llamar metales débiles, ya que su comportamiento se parece más a los semimetales que no a los metales. Veamos cómo reacciona el berilio con ambas cosas.
Ácido: BeO + H2O + 2H3O+ –> [Be(OH2)4]2+
Base: BeO + H2O + 2OH- –> [Be(OH)4]2-
Quiero que os deis cuenta de que esto es algo muy raro entre los metales, por eso he reiterado su extrañeza.
Las aleaciones de berilio son resistentes a la corrosión, son poco densas, resistentes y no magnéticas, y se usan en instrumentos de precisión como los giroscopios, satélites, misiles… Pedro lo comentó en su día y lo comento yo de nuevo: las ventanas de los tubos de rayos X se hacen de berilio, pues los rayos X se absorben cuanto mayor sea el numero atómico de los átomos, y el berilio es el metal con el número atómico más bajo que es estable en el aire, por lo que es muy transparente para los rayos X.
Mi profesor me comentó que las herramientas fabricadas en berilco (aleación de berilio y cobre) no producen chispas, pero ignoro el motivo, la verdad.
Sus compuestos son dulces pero no, no se usan en la industria alimenticia, pues son tremendamente venenosos. Y aquí yo me pregunto, ¿quiénes fueron los que decidieron probarlo? Un iluminado, o un envenenado, supongo…
Pedro habló de él aquí.
El magnesio es un elemento relativamente abundante en el universo y en la tierra, y, cómo no, no se encuentra en su forma elemental en la naturaleza. Es el alcalinotérreo más importante en lo que se refiere a sus aplicaciones. Se descubrió y se fabrica por electrolisis aunque se fabrica también a partir de un mineral suyo llamado dolomita (es el método pidgeon que comenta Pedro en el articulo correspondiente).
Es el tercer ion mas común en agua de mar después del sodio y del cloro (que es de aquí de donde se saca para la electrolisis), y en la corteza terrestre es también relativamente abundante.
El magnesio reacciona con un gas inerte como el nitrógeno, pero se oxida lentamente con el oxígeno del aire, además de que su oxido forma una capa impermeable que evita una futura oxidación del metal interno, pero el magnesio en polvo reacciona muy violentamente a altas temperaturas, y además la cosa no solo se pone muy caliente, sino que además emite una luz blanca muy brillante, además de radiación ultravioleta que puede convertirse espontáneamente en un vale para una visita al oculista.
2Mg + O2 –> 2MgO
Pero es que además es capaz de reaccionar con el agua y el dióxido de carbono de forma exotérmica.
2Mg + CO2 –> 2MgO + C
Os pongo un video muy chulo que ya puso Pedro en su momento.
¿Os habéis fijado en la cantidad ridícula de magnesio que reacciona y la luz que da?
Dicho de otra manera, el magnesio es inflamable, y no se apaga ni con agua ni con extintores convencionales, así que si alguna vez te encuentras involucrado con un fuego de un metal descontrolado mi consejo es que corras, mucho, avisando a todo el mundo que haga lo mismo si puede ser.
Una gran porción de la producción mundial de magnesio va directa para hacer aleaciones con aluminio, debido a su bajísima densidad (1,74 g/cm3), pues es el metal de construcción de más baja densidad. En otras palabras, coches, aviones, trenes… Como curiosidad diré que en los 70 del siglo pasado se fabricaron buques de guerra de dicha aleación, pero se “descubrió” en la guerra de las Malvinas que la temperatura a consecuencia de un ataque con misiles enciende como una vela el material.
Como la densidad de carga de su ion es muy alta, éste, al igual que el berilio, es capaz de formar enlaces covalentes para dar lugar a compuestos, como por ejemplo unos que ya han aparecido en El Tamiz, los reactivos de Grignard.
CH3-CH2Br(éter) + Mg –> CH3-CH2MgBr
La reacción es un ejemplo cualquiera, un reactivo de Grignard es aquel compuesto orgánico con magnesio y un átomo de la columna 17 juntos (es decir, un halógeno, como el cloro y el bromo).
El magnesio, por cierto, tiene un papel biológico tremendo, pues está presente en la clorofila, que se encarga de absorber la luz para la fotosíntesis en las plantas. En el cuerpo humano también es fundamental.
Además es protagonista de una cosa conocida como agua dura, de la que hablaré con el calcio.
Pedro habló de él aquí.
El calcio es un metal grisáceo. No blanco, lo siento. Es un elemento bastante común en la tierra y en el agua de mar, aunque no se obtuvo en su forma metálica hasta el descubrimiento de la electrolisis. Junto con el magnesio es el alcalinotérreo más importante, pero el calcio se usa muy poco en su forma metálica y mucho sus compuestos.
Como buen alcalinotérreo reacciona, aunque relativamente lentamente, con el oxígeno, el nitrógeno y con el agua.
Sus sales son en general solubles, pero algunas no lo son, y algunas de éstas son relativamente comunes. Una agua dura es aquella que se dice que tiene mucho calcio y magnesio disuelto. Este agua tiene sales disueltas en forma de bicarbonato, que es muy soluble, pero al calentarse este agua, el bicarbonato suelta dióxido de carbono y se forma carbonato de calcio, que no es otra cosa que piedra caliza, que se disuelve fatal.
Ca2++ + 2HCO3- CaCO3(s) + CO2 + H2O
Ésa es la típica “cal” que sale en los anuncios de la tele de lavadoras, que comentan que se queda pegado y destruye las lavadoras.
El ion calcio presente en nuestros huesos es el responsable de que en las radiografías los huesos se vean, ya que éste absorbe muy bien los rayos X. Obviamente el calcio tiene un papel muy importante biologicamente, en las personas, como en la práctica totalidad de los animales, forma parte de los huesos en forma de hidroxifosfato de calcio, Ca5(OH)(PO4)2, y aparte participa en la coagulación de la sangre y en la contracción de los músculos.
Pedró habló del calcio aquí.
El estroncio es un alcalinotérreo relativamente poco importante. Se descubrió por electrolisis y se parece bastante a su vecino superior, el calcio, pero éste ya es bastante más reactivo. Curiosamente no reacciona con el nitrógeno a temperatura ambiente, pero sí que arde con el oxígeno.
Durante muchos años desde el siglo XIX, la extracción de azúcar de la remolacha azucarera fue la mayor aplicación que tuvo, más tarde su uso se expandió de forma brutal debido a que se fabrican tubos de rayos catódicos con él, motivo por el cual hoy en día su uso en este mismo campo está cayendo en picado.
Suele usarse como indicador radiométrico para datar materiales geológicos, en los fuegos artificiales (color rojo) y en la medicina nuclear.
Es un elemento del que se investigan futuras aplicaciones.
Debido a su parecido con el calcio, el estroncio puede acumularse en los huesos sustituyendo al calcio, cosa que en cantidades muy bajas no implica riesgos (al parecer incluso puede ser beneficioso) pero al tener isotopos radiactivos relativamente comunes éstos sí pueden ser peligrosos.
Como curiosidad os diré que España es uno de los principales productores de estroncio, por detrás de China.
El bario es el ultimo de los metales alcalinotérreos (sin contar el radio). Es el más reactivo y de los que menos usos industriales tiene. Se descubrió igualmente mediante la electrolisis.
Es difícil de obtener bario puro, así que algunas de sus propiedades no se han obtenido del todo, pero eso ya es un indicador de que tiene pocas salidas, al menos en su forma metálica. Lo cierto es que el bario metálico reacciona con… todo. Y rápida y exotérmicamente. Incluso con el oxígeno reacciona para dar, no solo óxido de bario, BaO, sino también peróxido de bario BaO2.
Como reacciona con todo se usa mediante aleaciones para eliminar la presencia de gases no deseados en tubos de vacío para fabricar, otra vez, tubos de rayos catódicos, por lo que su uso está cayendo en este sentido. Se usa para dar color verde a los fuegos artificiales, para multitud de aleaciones, para fabricar un superconductor de alta temperatura específico, y su mayor uso lo tiene en la industria del petroleo como material suplementario en los fluidos de perforación.
Como el bario absorbe muy bien los rayos X se puede hacer que alguien ingiera una suspensión de sulfato de bario en agua para poder observar los órganos internos, que no absorben bien los rayos X. El bario es bastante tóxico, pero el sulfato de bario es tan poco soluble que no implica ningún peligro.
El radio es el metal alcalinotérreo menos importante, con diferencia. Su descubrimiento por Marie Curie creo que es una historia bien conocida ya en El Tamiz, así que no creo que sea conveniente que la comente aquí.
No hay isótopos estables del radio: el que tiene el periodo de semidesintegración más largo es el radio 226, de 1601 años. Debido a su elevada radiactividad, el radio es luminiscente, brilla con un ligero color azul que, aunque parezca mentira, se usó en sus momentos para hacer que las manecillas de los relojes brillaran, pinturas brillantes para aviones, mezclado en agua embotellada por sus propiedades “curadoras” y tal. La historia de los “usos” del radio es, como poco, escalofriante.
De todas maneras, la producción de radio es ridícula porque, como ya he dicho, industrialmente no tiene aplicaciones, como mucho en centros de investigación.
El metal en sí es muy parecido al bario en general.
Óxidos: todos los óxidos de los metales alcalinotérreos (olvidaos del berilio otra vez) menos el del magnesio, que es muy insoluble, reaccionan con el agua para dar el hidróxido del metal.
SrO + H2O –> Sr(OH)2
El oxido de magnesio se usa para recubrir hornos industriales debido a su alta temperatura de fusión (2825ºC). Su elevada conductividad calorífica y su muy baja conductividad eléctrica a cualquier temperatura lo hace importantísimo para fabricar estufas eléctricas.
El óxido de calcio, CaO, se prepara calentando piedra caliza o carbonato de calcio y es la llamada cal viva, que tiene múltiples usos desde tiempos inmemoriales, por ejemplo en la industria del acero y la del papel.
CaCO3 –calor-> CaO + CO2
La cal viva se usaba antes para iluminar teatros, ya que al dirigírsele una llama emite una fuerte luz blanca. Además, su punto de fusión es muy elevado. No obstante, la cal viva es bastante peligrosa, porque como buen óxido de metal alcalinotérreo reacciona con el agua (y con la piel, deshidratando la piel con la que entre en contacto) y forma la llamada cal apagada, hidróxido de calcio o Ca(OH)2.
Hidróxidos: los hidróxidos de los alcalinotérreos varían de insoluble a soluble de arriba a abajo. La insolubilidad del hidróxido de magnesio se aprovecha para darle el peculiar uso de antiácido estomacal, pues, a fin de neutralizar el exceso de ácido, la idea es ingerir algo básico, pero las bases pueden llegar a ser muy corrosivas y las quemaduras que provocarían serían de aúpa, así que es mucho más practico algo como el hidróxido de magnesio, que es básico pero muy insoluble, para que reaccione directamente en el estomago con el ácido.
Mg(OH)2 + 2H+ –> Mg2+ + H2O
Todas las sales de magnesio son laxantes, por cierto. Y como curiosidad os contaré que no hace muchos años en España murieron un par de personas o así porque les dieron por equivocación una sal de manganeso en vez de una de magnesio…
Sulfatos de magnesio y calcio: son el MgSO4 y el CaSO4. El primero, en su forma heptahidratada se usó intensivamente como laxante durante el siglo XIX. El de calcio en su forma dihitratada tiene el nombre común de yeso, que como todos sabéis se ha usado para hacer esculturas y construcciones desde tiempos muy antiguos.
El yeso, además, se aprovecha para construir muros interiores de edificios debido a su elevada resistencia al fuego. Esta resistencia viene dada por tres motivos: primero, porque la deshidratación del yeso es una reacción endotérmica; segundo, porque el agua producida absorbe calor para evaporarse; y tercero, porque el vapor de agua reduce el suministro de oxigeno en un ambiente relativamente cerrado. Además es un material barato y, obviamente, no inflamable.
Carbonato de calcio: el CaCO3 se encuentra en la naturaleza en forma de piedra caliza o mármol (que es casi en su totalidad carbonato de calcio que ha sido sometido a altas presiones). Es de lo que están hechas las estalactitas y estalagmitas, pues las gotas de agua disuelven el CO2 atmosférico, el cual reacciona con nuestro carbonato de calcio que se encuentra en el suelo:
CaCO3 + H2O(l) + CO2 –> Ca(HCO3)2(aq)
La roca se disuelve y puede escurrirse hasta que se evapora el agua para dar lugar la reacción contraria:
Ca(HCO3)2(aq) –> CaCO3 + H2O(g) + CO2
Y así con el lento, lento paso de los años esta disolución y deposición de carbonato de calcio acaba formando estas bellas estructuras:
Las reacciones superiores parecen una curiosidad, pero hay que tener en cuenta que antiguamente muchos edificios se construían con carbonato de calcio, por lo que con la lluvia y los contaminantes ácidos de las industrias, el proceso causa un lento deterioro de esculturas de mármol y diversos edificios.
Se usa para fabricar acero, vidrio, hormigón y cemento.
Cemento: Sí, cemento. El hidróxido de calcio reacciona con el dióxido de carbono para formar carbonato de calcio. Pues bien, esto es un hecho el cual el ser humano ha aprovechado desde hace muchos años para fabricar una pasta para pegar tabiques y construir edificios.
En la actualidad se fabrican más de 3.300 millones de toneladas de cemento en el mundo.[1] Obviamente nuestro cemento es más sofisticado que el que usaban en la antigüedad.
El cemento Portland, nombre el cual es muy posible que hayáis visto alguna vez en un saco de cemento, se fabrica mezclando y calentando piedra caliza y pizarras a alta temperatura. El resultado se pulveriza y se mezcla con un poco de sulfato de calcio. La mezcla resultante, cuando se junta con agua, dará lugar a reacciones de hidratación, que es lo que se usa ya para pegar tabiques y tal.
El cemento tiene mucha ciencia detrás, ya lo creo.
Cloruro de Calcio: En su versión anhidra, el CaCl2 tiene la capacidad de absorber muy bien la humedad, hecho que se aprovecha en el laboratorio como agente secante. La hidratación de este compuesto es una reacción bastante exotérmica, reacción que se aprovecha (o al menos se aprovechaba antes) para vender compresas de agua caliente instantánea que simplemente se basan en dos bolsas separadas, una con agua y la otra con cloruro de calcio anhidro que al oprimir el paquete se rompen haciendo que se mezclan ambos contenidos.
Se usa para fundir nieve de manera muchísimo mas eficiente que con cloruro de sodio: para empezar por su reacción exotérmica, y segundo, porque la mezcla de agua con éste hace que la disolución permanezca liquida hasta -50ºC.
Y hasta aquí llegan los metales alcalinotérreos. ¿Qué os ha parecido? Hay mucho que contar de cada elemento, pero espero que al haber leído esto ahora sepáis algo más que antes de empezar.
En el próximo artículo daremos un gran salto en la tabla periódica y nos situaremos en la columna 13, el grupo del boro, columna que será mas complicada de tratar debido a que tiene metales y no metales en ella, y como consecuencia, las propiedades ya no se pueden generalizar tanto.
Hasta la siguiente columna.
- Datos de 2010. [↩]

The La tabla periódica VII – Los metales alcalinotérreos. by , unless otherwise expressly stated, is licensed under a Creative Commons Attribution-Noncommercial-No Derivative Works 2.5 Spain License.








{ 5 } Comentarios
A mi entender aquí falta algo para que quede bien, “ejemplo, el calcio, el estroncio y el bario reaccionan con agua fría, pero el bario es el que [lo hace] más vigorosamente:”
Me ha gustado mucho el artículo, muy interesante!
Corregido el pequeño error, gracias por decirlo y por comentar. Y me alegro de que haya gustado!
hola A.Giron una pregunta me recomendaron tomar cloruro de magnesio para mejorar mi salud, y porque presento insomnio recurrente.crónico, 33grs en un litro de agua y tomar una cucharada en ayuno, pero antes me hice estudios de cortizol y litio y resulta que el primero esta en valores normales, pero el segundo esta en 0.00. ES CONVENIENTE QUE TOME EL CLORURO DE MAGNESIO, QUE ME RECOMIENDA USSTED
El berilio es un elemento muy importante en las esmeraldas .
Angeles, este no es buen lugar para preguntar esas cosas. Consulta un medico (uno de verdad, de los de un hospital publico) y sino te convence pregunta a otro. Si quieres estar mas segura busca estudios serios publicados en revistas con revision de pares y a ser posibles realizados en centros de prestigio. Lleva su tiempo, pero no dejes que nadie lo haga por ti a no ser que sea un medico.
{ 1 } Trackback
[...] en la tabla periódica justo por debajo del calcio y por encima del bario. Es, por lo tanto, un metal alcalinotérreo cuya tendencia natural es librarse de dos electrones para alcanzar la estabilidad electrónica. [...]
Escribe un comentario