En la entrada anterior de la serie La Biografía de la Vida hablamos del escenario en donde se iba a desarrollar el drama. La Tierra comenzaba su andadura. Acabábamos planteando un hilo argumental sobre los puntos de encuentro de todos los organismos vivos, hilo que iremos desarrollando en un futuro, aunque hoy aún nos moveremos por temas muy generales, incluso elementales para la gran mayoría, que encuadran el camino. En un primer bloque de esta entrada la química es la protagonista y en él pretendo no sólo complementar el conocimiento con la presentación de los actores elementales, las moléculas orgánicas, sino también dejar en la mente de todos los lectores la idea de que los juegos de la química elemental, que más tarde dio origen a la química orgánica, fueron unos procesos naturales, elementales y obligatorios. La bioquímica tuvo que aparecer si o si. En un segundo bloque de esta entrada seguiremos con el relato biográfico, profundizando un escalón más en los misterios del inicio, aún dentro de los 770 millones de años que duró el Hadeico.
De las profundidades de este eón, entre fuego y explosiones, a través de un agitado caminar hacia la estabilidad, surgieron como de la nada, empujados por las fuerzas universales, nuestro planeta Tierra, y sobre él una misteriosa Vida. En este momento de su biografía vamos a intentar desmadejar, en la medida de lo que el conocimiento actual nos permite, cómo sucedió todo.
En la entrada anterior, introductoria del Hadeico, fuimos manejando muchas palabras nuevas, diferentes realidades moleculares y actores desconocidos, como no podía ser menos casi en el inicio de esta biografía. Hablaremos de todos tarde o temprano, empezando a continuación con los más elementales, que no por ello dejan de ser menos trascendentales, en los cimientos de esto que llamamos Vida. Sin ello puede quedar la tramoya ininteligible. Ahí va, pues, un poco de química.
La Vida pudo escoger a su viejo patriarca entre varios de los habitantes de la tabla periódica de elementos químicos. Pero eligió al Carbono.
Nuestro amigo el carbono
Y el Carbono organizó su trabajo echando mano de los elementos más abundantes del entorno que le rodeaba y que fueran compatibles con su especial “fenotipo” –su cara visible-: formaron el equipo de los bioelementos.[1] Todos ellos pueden unirse formando diversas asociaciones químicas, las moléculas. Un poco más abajo intentaremos desmitificar la “alquimia” de tales enlaces.
Así que la mayor parte de las moléculas que componen los seres vivos tienen su base en el carbono, el cual representa aproximadamente un 20% del peso de los organismos. Este elemento muestra una serie de propiedades muy diversas que derivan de su pequeño radio atómico y de que la capa más externa de su bagaje electrónico está formada por cuatro electrones que le dan una gran versatilidad y múltiples habilidades:
1. Ofrece una amistad universal: Su particular estructura de electrones le permite formar enlaces hasta con cuatro elementos distintos, lo que le da una increíble variabilidad molecular. A su vez estos enlaces pueden ser sencillos, dobles o triples, lo que quiere decir que puede agarrar con una, dos o con tres manos a la vez.
2. Sabe hacer fuertes amigos: Cuando se junta con otros elementos en una molécula, forma con sus compañeros enlaces de unión del tipo denominado covalente, que son muy estables y acumulan mucha energía.
3. Su red social es potente: Es un elemento que puede formar largas cadenas lineales, planas o tridimensionales, ya que se puede unir fácilmente a otros carbonos. Por lo que iremos viendo a lo largo de estos primeros capítulos se entenderá la importancia que para el metabolismo y la vida es el poder tener moléculas estructuralmente complejas.
4. Sabe amoldarse a las circunstancias: Los compuestos del carbono, aún siendo estables, no son inalterables y a la vez pueden ser transformados con facilidad en otros mediante reacciones químicas.
5. Sus facetas de comunicación son versátiles: Los compuestos del carbono no son solamente sólidos, sino que al unirse al oxígeno los forma gaseosos.
Quizás por todo ello fue el preferido por la Vida.

Los cuatro orbitales electrónicos más externos del átomo de carbono. En el centro, el núcleo atómico (Wikimedia, GFDL 1.2)
El principal aliado del carbono en la aventura de la vida es la molécula del agua: H2O. El agua es el disolvente perfecto, por lo que es esencial en el mantenimiento de un medio en donde las moléculas químicas puedan moverse e interrelacionarse. Su capacidad de disociarse fácilmente en forma de iones H+ y OH- le permite ser un excelente mediador en las reacciones de óxido-reducción esenciales en la dinámica de la Vida. Por otro lado, tiene una capacidad calorífica muy alta –absorbe bien el calor sin aumentar su temperatura- lo que estabiliza las condiciones biológicas en los organismos que funcionan mediante energéticas reacciones químicas. Podemos comprender, por tanto, que su función es absolutamente esencial: sin agua no hay Vida tal como la conocemos. Esta molécula es la más abundante de los seres vivos y representa, en promedio, el 70% de su masa. Aunque hay algunos campeones: en las medusas puede alcanzar el 98% del volumen del animal, y en la lechuga, el 97% del volumen de la planta.
Un poco de química molecular
Me interesa ahora resaltar la estructura de átomos y moléculas, sus formas y tal como tienen distribuidas sus cargas eléctricas. Ya que, según sea, así se interrelacionarán formando compuestos, entre ellos los que se encuentran en la base de la Vida.
La imagen que voy a dibujar es la elemental de átomos y moléculas, aunque es tan sencilla que veremos cómo se parece a la de una pieza de “lego” imantada. Podemos imaginar a la química como una caja de versátiles piezas encadenables e intercambiables, gracias a la fuerza de atracción-repulsión de sus cargas eléctricas, que actúan sobre una pista de pruebas diseñada por las leyes físicas y termodinámicas universales del Cosmos.
Un átomo, y por extensión una molécula más compleja, son ínfimas, son aparentemente la nada. Pongamos una naranja en el centro de un campo de fútbol. Esta naranja es el núcleo del átomo, en donde los protones con carga positiva, su tarjeta de identidad, cohabitan con los neutrones. No esperemos encontrar a los terceros de la fauna atómica, los electrones, en el césped del campo de juego. Para ello tenemos que mirar más allá, por los confines del graderío de estadio. El número de este colectivo coincide con el de los protones del núcleo y con un valor de su carga negativa igual a la positiva de los protones, neutralizando así la carga total del átomo. Si la naranja es de un kilo, no espere más de un gramo de electrones revoloteando entre los asientos. Vacío. Un poco de materia, que es mucho, y una activa fuerza electromagnética.
Los electrones no revolotean como un sistema planetario a lo largo y ancho de perfectas capas superpuestas, como las de una cebolla, aunque esta imagen es bastante útil para imaginar la configuración electrónica de los átomos. Estas partículas se posicionan rodeando al núcleo de forma que comienzan rellenando su capa interior, menos energética, para una vez saturada con dos electrones llenar la siguiente hacia fuera con ocho y luego la siguiente hacia fuera, así hasta colocar una cantidad de pequeñas partículas negativas en un número igual al de los protones del núcleo. Pero las “capas de cebolla” tienen formas curiosas, como podemos verlo en la figura de más abajo que representa los orbitales electrónicos de la segunda capa. Cada electrón dibuja su propio orbital de acuerdo a sus características cuánticas y según su ecuación de onda. El resultado es una solución probabilística que no sólo podríamos imaginar como un lugar físico, sino el lugar físico donde es más probable que encontremos al electrón… ¡cosas de la cuántica! Y tienen la forma y tamaño que tienen, no otro, ¡más caprichos de la cuántica! Ahora podemos comprender el por qué del vacío del átomo: los electrones tienen que poder encajar sus orbitales en este espacio. Que además alberga a multitud de partículas virtuales surgidas del borboteo cuántico. Pero eso es otra historia.[2]
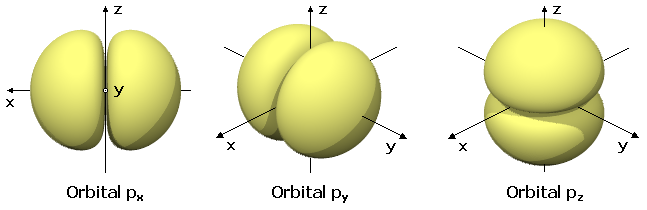
Ejemplo de cómo son los orbitales electrónicos de la segunda capa. Raritos ¿no? (Wikimedia, GFDL 1.2)
Es fácil entender que el átomo se relaciona con su entorno mostrando sus orbitales más externos –que no son más que las locas pistas de carreras de electrones con carga negativa-, los cuales actúan como tentáculos con los que formar moléculas. Pero no hay que olvidar que en su pequeño punto central se encuentran los protones con sus cargas positivas, que condicionan la energía y el movimiento de los electrones, es decir, condicionan las características de los orbitales sus formas y fuerzas.[3] Todo ello hace que cada átomo se comporte como un pequeño imán, una pequeña pieza de lego imantada, con los brazos –algo así podemos entender que son los orbitales aunque no es exactamente correcto- exteriores, que son los elementos de unión mediante los que las piezas hagan “clik”. Y según sea su configuración, así se relaciona.
Los átomos, como todo en la naturaleza, tienden espontáneamente a buscar posiciones en un entorno energético “redondo”, como una piedra que bajo la acción de la gravedad no para hasta encontrar su posición estable en el fondo del valle. El óptimo energético lo encuentran cuando en su capa externa hay tantos electrones como teóricamente sea posible. Algunos están cerca de este óptimo por exceso, les sobran unos pocos electrones, y otros por defecto, les faltan otros pocos. Y ahí es donde colaboran unos con otros prestándose electrones, de forma que los átomos lleguen a formar una molécula que a su vez tenderá a instalarse también en una posición energética “redonda”. A veces estas uniones son prácticamente espontáneas: las piezas de lego que participan encajan espontáneamente como anillo al dedo. A veces hay que darles un empujoncito para vencer la repulsión negativa entre sus capas externas, sólo hay que buscar un poco de energía para cebar la reacción. Su entorno también tiene algo que decir, ya que influye en sus movimientos y velocidades, sus trayectorias, sus energías cinéticas, etc, circunstancias todas ellas que condicionan el baile de aproximaciones y choques. Incluso hay otras moléculas que espontáneamente se ofrecen como casamenteras, las catalizadoras, agilizando de forma exponencial la formación de la nueva molécula. Si todo es favorable, y la probabilidad de que así sea no es que sea precisamente baja, se formará un enlace y una nueva molécula químicamente más estable: la segunda ley de la Termodinámica manda. La verdad es que nuestra experiencia constata que la química de la naturaleza dispone para ello de un manual absolutamente versátil.
Tras el anterior largo paréntesis teórico recojo argumentos y me concentro en la moraleja: la unión de átomos y la configuración de nuevas moléculas no es un acto de magia, sino un suceso que la naturaleza propicia. Si las condiciones de entorno, pastoreadas por las omnipresentes leyes fundamentales y universales del Cosmos, son medianamente favorables, sucederá sí o sí. Y llegaremos a estructuras complejas como la del azúcar de la figura siguiente, o extremadamente complejas como la de la hemoglobina. Esta “involuntaria” dinámica llevó a los sorprendentes “imanes-lego” a construir la Vida. Y esto sí es una certeza para nosotros que estamos observando el final de la historia.

A la izquierda representación tridimensional de la molécula del agua (Wikimedia, dominio público) y a la derecha la de la D-glucosa (Wikimedia, dominio público). Las esferas representan los átomos: el carbono en negro, el oxígeno en rojo y el hidrógeno en blanco. Las barras entre átomos representan los orbitales moleculares, allí por donde aparece la densidad electrónica con mayor probabilidad.
Continuemos ahora hablando, con nombres y apellidos, de los ladrillos con los que se ha ido montando el guión, ya en el ámbito de la bioquímica, ladrillos formados en su mayoría por carbono, oxígeno e hidrógeno. O quizás mejor, CO2 y H2O.
Las biomoléculas
Los bioelementos se combinan entre sí para formar las moléculas que componen la materia viva. Estas moléculas orgánicas basadas en el carbono las podemos agrupar en familias, que como podemos imaginar se van a diferenciar por sus estructuras moleculares. Aquí vamos a obviar estas estructuras para centrarnos en sus funcionalidades dentro del marco de necesidades de un organismo vivo, que precisa alimentarse, construir un entramado físico en donde mantener una actividad vital, comunicarse con el medio y, finalmente, reproducirse y transmitir su herencia.
En la función de nutrición tienen un especial peso los lípidos (grasas) y los glúcidos (azúcares). Estos últimos también participan activamente en la estructura informativa de los ácidos nucleicos ADN o ARN, e incluso colaborando con proteínas en tejidos de sostén.
Los lípidos también son los elementos esenciales en determinadas estructuras celulares, gracias a sus largas cadenas moleculares, como la del ácido esteárico en la figura siguiente.
Las proteínas, uno de los prótidos, son las “funcionarias” que soportan el sistema: con sus moléculas construyen los entramados estructurales de los organismos, con su trabajo enzimático agilizan las reacciones metabólicas que son la base de la vida e incluso participan como actrices directas en las mismas, son los vehículos de transporte de diversas sustancias a nivel celular, nos defienden de amenazas exteriores del organismo… y un largo etcétera. Son largas moléculas, con un intrincado y esencial enmadejamiento estructural, formadas por una cadena de aminoácidos, otro de los prótidos esenciales. La forma de la madeja depende de la secuencia de aminoácidos, su forma geométrica y los posibles enlaces “intramoleculares” (como puentes de hidrógeno[4]) independientes de los propios que forman el polímero, siendo esta especial estructura enmarañada la característica esencial que condiciona su función. Así como sea su forma, condiciona los espacios de acoplamiento con otras moléculas y las posibilidades de enlaces adicionales químicos mediante sus grupos fosfato o creando puentes de hidrógeno, entre otros.

La proteína hemoglobina, formada por cuatro proteínas globulares (Wikimedia, GFDL 1.2)
La responsabilidad de la función de herencia recae sobre los ácidos nucleicos, el ADN y el ARN. De ellos hablaremos con mucho más detalle en una próxima entrada. Baste decir aquí que sus moléculas están formadas por largas cadenas de lo que llamamos nucleótidos, un entramado molecular de cooperación a tres entre un azúcar, una base nitrogenada -unas especiales moléculas orgánicas que forman anillos- y un grupo fosfato –el ión PO43−-. Sus funciones también se extienden al campo enzimático, facilitando las catálisis, y metabólico, fabricando proteínas y autorreparándose. Las cadenas del ADN están formadas por una hélice de doble hebra mientras que las moléculas de ARN pueden formar estas hélices aunque son de hebra simple, a veces cerrada sobre si misma.

La falsa doble cadena del ARN (Wikimedia, GFDL 1.2)
Una vez conocidos los participantes, profundizaremos en el cómo, cual debió ser la forma más plausible para que con estos mimbres pudiera representarse la función de la Vida:
¿Cómo apareció realmente la Vida en la Tierra? ¿Qué es lo que mejor sabemos de ello?
Son muchas las teorías, y explicaremos las más importantes por su trascendencia a lo largo del camino del conocimiento y por sus sólidas bases científicas. Hay que decir que todo son especulaciones, pero con una alta probabilidad de que funcionen, al menos con una probabilidad más alta que la que tienen otras explicaciones puestas sobre la mesa. Conocer con exactitud lo que pasó es una utopía, ya que exigiría revivir la historia geológica, y esto es un imposible. Los seres vivos más próximos en el tiempo han dejado un reguero importante de fósiles, sin embargo la Vida más antigua ha dejado solamente unas pistas químicas, enmarcadas en un entorno ambiental al que podemos analizar con un grado de especulación que resulta confortable para la ciencia. A partir de todo ello hay que conjeturar lo que pasó, ponerlo en el escenario del conocimiento, contrastarlo y someterlo a una crítica continua.
Vamos a dejar de lado las teorías de corte aristotélico que postulan una generación espontánea de la Vida por estar científicamente más que superadas.
Hay teóricos que opinan que la Vida vino del exterior, la panespermia, aminoácidos a caballo de meteoritos y cometas que cayeron sobre la Tierra y que fueron la semilla para una expansión futura. Científicos tan prestigiosos como el británico Sir Fred Hoyle postulaban esta posibilidad, ya que consideraba que el inicio de la Vida en la Tierra comportaba una mínima e increíble probabilidad. Hoy se sabe que el espacio interestelar está repleto de biomoléculas. En 1969 cayó un meteorito en Murchison, Australia, en el que, al ser analizado, se pudo detectar restos orgánicos y de aminoácidos. Estos resultados se repitieron en los análisis realizados con otros meteoritos.

Estructura del ALH84001 (Wikimedia, dominio público NASA)
Hay un segundo hecho relacionado también con meteoritos, esta vez de origen marciano, el ALH84001 que fue encontrado en la Antártida en 1984. Los gases que encerraba corroboraron su origen en el planeta rojo. Con una antigüedad de 4.500 millones de años, debió de saltar durante una de las terribles y múltiples colisiones de objetos que se daban en aquella época en el sistema solar interior. Presenta unas vetas de calcita que se forman por infiltraciones de agua, una pista de la Vida, al menos del tipo que conocemos en la Tierra. Se hallaron también granos minerales de magnetita de posible origen bacteriano, moléculas orgánicas y unos cuerpos que bien pudieran ser bacilos, como se ve en la fotografía anterior (aunque hay también opiniones en contra).
Sin embargo, si éste hubiera sido el germen de la Vida en la Tierra siempre quedaría en el aire la pregunta de cómo se inició en el espacio, fuera de nuestro planeta.
Si el origen físico de la Vida se produjo realmente sobre la Tierra, debió surgir progresivamente a lo largo de un proceso con raíces en un mundo de química abiótica y que desembocó en un mundo de química biológica elemental: a este proceso se le conoce como la síntesis abiogénica, nombre que proviene del griego α- “no”, βιος- “vida” y γενεσις- “principio”, el inicio de la Vida desde una “no-vida”.
Son muchas las mentes teóricas que han discurrido sobre cómo pudieron ser los inicios de la Vida, cómo a partir de los átomos más elementales se llegó a las moléculas complejas que gestionan lo que hoy llamamos Vida. Comenzando por las ideas del bioquímico soviético Alexander I. Oparin y del biólogo evolutivo británico J.B.S. Haldane, padres al alimón y desconexos de la abiogénesis, ninguna teoría por sí misma da una explicación completa, e incluso algunas de ellas son meramente especulaciones sin un soporte experimental, por otro lado difícil de conseguir dada la baja probabilidad de reproducir en un laboratorio aquellos desconocidos inicios. En el mundo de la ciencia hay dos corrientes principales de opinión, las que apuestan porque la complejidad se inició como un mundo de información y replicación, en donde el material genético fue perfeccionando su función, y las que argumentan que el metabolismo, la máquina interna de los organismos, apareció antes que los sistemas codificadores de información. Entre las del primer grupo se encuentra la conocida teoría del mundo de ARN, postulada por el premio nobel Walter Gilbert en 1986, donde el ácido ribonucleico desarrollaría funciones tanto de archivo de la información como de catálisis química. Entre las del segundo grupo está la teoría del mundo de hierro y azufre que postuló en 1989 Günter Wächtershäuser.
Alexander I. Oparin fue el primero que teorizó en 1924 una evolución espontánea molecular que daba lugar a ciertos agregados complejos, que bautizó como coacervados. Él había observado que los principales ladrillos de la vida orgánica, como podían ser los azúcares, los aminoácidos o las proteínas, se podían sintetizar a través de procesos de laboratorio que no diferirían en gran medida de las condiciones y lo que pudo haber pasado en la Tierra más antigua. Estaba convencido de que en las aguas de los océanos primitivos debieron formarse sustancias orgánicas muy complejas y diversas, semejantes a las que constituyen los actuales organismos, aunque también era consciente de que una cosa es un ser vivo y otra una disolución de moléculas, de tamaño más o menos grande, en agua. Y se puso a estudiar el mundo de las disoluciones coloidales de moléculas relativamente grandes, en las que observó una cierta anarquía e inestabilidad, entre las que de vez en cuando, a través de un proceso muy sencillo y espontáneo, se estabilizaban grumos de ciertas moléculas, decantándose como un sedimento o formando unos coágulos en equilibrio dentro del coloide. Todo dependía del tipo y estructura de las moléculas. A esos grumos, como ya hemos comentado, les llamó coacervados, del latín acervus, montón.
Los coacervados tenían una propiedad muy especial: habían condensado todas las moléculas de la solución coloidal primitiva de forma que ahora sólo se observaban unos grumos casi sin agua, rodeados de agua prácticamente pura, con la que no se mezclaban nunca. Ésta es la misma propiedad que tiene el protoplasma de las células vivas.
Dentro de los coacervados Oparin observó otra interesante particularidad: a pesar de su consistencia líquida, tenían cierta estructura interna. Las moléculas coloidales que los formaban no se encontraban dispersas al azar, sino que estaban dispuestas con una cierta estructura espacial y con una capacidad, en la mayoría de los casos, de absorber distintas substancias que se encontraban en la solución que les rodea. Esto solía provocar transformaciones químicas en su interior. La consecuencia de todo ello es que los coacervados podían aumentar de volumen y crecer a expensas de las sustancias externas absorbidas en su núcleo, aunque no todos lo hacían por igual.

Coacervados de Oparin (Wikimedia, dominio público)
A partir de todo lo anterior le fue fácil colegir que la mezcla de distintos cuerpos proteinoides primitivos -que se habían formado espontáneamente como los aminoácidos interestelares- en las aguas de la Tierra primigenia debió de dar origen a la formación de coacervados, que evidentemente no se podían calificar aún como seres vivos, pero que llevaban la semilla de la vida en su interior. Y al igual que en el laboratorio, cada coacervado desarrollaría una química distinta, dependiendo de cómo se hubiera organizado su estructura interna y de qué tipo de moléculas se iba encontrando en el medio exterior. Algunas opciones resultaron útiles, se conservaron y crecieron, mientras que otras fueron desapareciendo, aisladas por la presión medioambiental. Un inicio de la estrategia de la selección natural.
Las que crecieron lo hacían hasta un tamaño permitido por las leyes físicas y termodinámicas, más allá del cual el coacervado se debía romper en dos o más hijos, que poseerían una química idéntica a la del antecesor, es decir, habían heredado una química ganadora. Y tendrían aún más ventajas los que crecieran más deprisa, aquellos que tuvieran una mayor capacidad de absorción de moléculas externas, con lo que su química interna se iría complicando y haciendo todavía más rápida. Se comprende perfectamente que estos coacervados, dinámicos en su química y reproducción y estables en sus repetitivos procesos de replicación de sus componentes, podían haber tenido grandes ventajas sobre los demás coacervados que flotaban en la misma solución primigenia.
Y así, siguiendo un camino de incremento de la complejidad dentro de la estabilidad, se llegaría a un ser metabolizante y replicante, al ser vivo más primitivo. La teoría de Oparin, sin ser verdaderamente exacta, ha iluminado un camino probable, una senda de progresiva especialización molecular que pudo hacer posible el inicio de la Vida.
En los siguientes párrafos enhebraremos a lo largo de una misma historia cronológica lo que pudo ser el desarrollo de las biomoléculas a partir de la “nada”, historia compuesta por retazos del ya comentado extenso universo de teorías sobre la abiogénesis. En la lectura de esta exposición no se nos debe olvidar en ningún momento que se trata de un relato posible –bastante probable a la luz del conocimiento actual-, aunque especulativo, y no se nos debe olvidar tampoco que el proceso es el sumatorio a lo largo del tiempo de una sucesión de cambios infinitesimales, modelados en cada momento por su particular medio ambiente.
Los inicios son claros de puro simples: Vemos un mundo de gases y polvo. Los elementos químicos revolotean en la espiral de acreción de la Tierra. Poco a poco se van juntando y van creando alianzas. En un primer momento todo fue muy sencillo.
Ya hemos comentado cómo las leyes de la química, de la termodinámica y del universo en general actuaban de forma “impersonal” y silenciosa, pero insistente. El electromagnetismo es la base de la unión, cargas positivas con cargas negativas: intercambios de electrones, enlaces iónicos y enlaces covalentes.
De las moléculas sencillas se tuvo que pasar a la complejidad. La Vida necesita moléculas sencillas, como el agua, o el amoniaco, o el metano. O el dióxido de carbono, o el cianhídrico… moléculas que ya sabemos que estuvieron desde el principio presentes como resultado de procesos geoquímicos naturales.
Pero también necesita de la complejidad, así que el nacimiento de las moléculas orgánicas fue otra cosa. Como ya hemos comentado, hay múltiples teorías que postulan un posible camino, pero en general la hoja de ruta comúnmente suele pasar por los siguientes pasos:
1. Creación de ciertas moléculas pequeñas básicas para la vida, como los azúcares, nucleótidos o aminoácidos, ladrillos elementales de moléculas más complejas como los ácidos nucleicos –ARN, ADN- y las proteínas.
2. Generación de fosfolípidos, moléculas de ácidos grasos con átomos de fósforo, imprescindibles para la formación de membranas cerradas, elemento clave para el metabolismo celular.
3. Fusión de nucleótidos formando cadenas de ácidos nucleicos, inicialmente de tipo ARN.
4. La “conquista” de la función enzimática por algunos ácidos nucleicos al aparecer las ribozimas –enzimas basadas en la ribosa, componente del ARN-, que catalizarían la síntesis de pequeñas proteínas.
5. Diversificación funcional: los ácidos nucleicos quedarán como portadores de información genética, mientras que las proteínas catalizarán las reacciones metabólicas.
Y hasta aquí los aspectos generales. En la próxima entrada hablaremos más concretamente sobre el posible arranque de la Bioquímica, que es lo mismo que decir de la Vida.
- Los bioelementos o elementos biogénicos son los elementos químicos qu están presentes en los seres vivos. La materia viva está constituida por unos 70 elementos, la práctica totalidad de los elementos estables que hay en la Tierra, excepto los gases nobles. No obstante, los más frecuentes en los organismos vivos, de forma que entre todos ellos aportan más o menos un 96% de sus masas, son los siguientes: el carbono C, el hidrógeno H, el oxígeno O, el nitrógeno N, el fósforo P y el azufre S. Luego, en menor proporción (3,9%), participan el calcio Ca, sodio Na, potasio K, cloro Cl, yodo I, magnesio Mg y hierro Fe. [↩]
- Quien tenga curiosidad no puede dejar de leer la magnífica serie sobre cuántica sin fórmulas de Pedro en el blog hermano El Tamiz. [↩]
- Es muy interesante el artículo publicado en el blog Experiencia Docet acerca de este tema “El origen matemático de los números cuánticos y de los orbitales atómicos”. [↩]
- La molécula del agua es dipolar, es decir actúa como un pequeño imán ya que los protones del núcleo del oxígeno desplazan ligeramente a toda la carga negativa de los electrones de la molécula del agua. El extremo del oxígeno actúa como polo negativo y el de los hidrógenos como polo positivo. Polo positivo que es capaz de promover enlaces electromagnéticos con los polos negativos de otras moléculas -incluso otras de del agua-. [↩]

The La biografía de la Vida 02. Algunas generalidades by , unless otherwise expressly stated, is licensed under a Creative Commons Attribution-Noncommercial-No Derivative Works 2.5 Spain License.


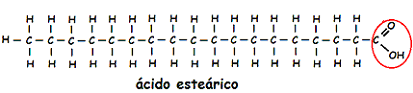


{ 13 } Comentarios
No sé cuanto tiempo paso entre el artículo anterior y este, pero yo sentí que era una eternidad, justo ayer estaba pensando cuando iba a aparecer otro articulo. Gracias por la contribución este tema me fascina
Hola Lou, gracias por tus ánimos. Están preparadas ya las siguientes entregas, pero hay que esperar el turno que fija la buena gestión de El Cedazo. De todas formas creo que los administradores van a intentar acelerar las entradas. Estoy seguro de ello.
Excelente artículo. Las series de El cedazo son cada vez mejores, y eso que el listón está altísimo.
Muchas gracias Laertes por tus fantástico comentario. Puede que lo que se escribe en el Cedazo es el resultado de unas relaciones tema-autor rayanas en el enamoramiento. Cursi pero en mi caso bastante real. Procuraré seguir así.
Gran artículo sin duda
¡Pues ya veréis los que vienen!!!
Sabía que “no debía” comentar hasta echar una ojeada a los siguientes, jeje. Me he pasado los dos primeros artículos preguntándome ¿y el Experimento de Stanley Miller? ¿Y Miller? Y héte aquí que lo hallo en el tercero. Muy completos los artículos, me gusta tu estilo llano y coloquial pero a la vez didáctico; se nota en él el peso de la experiencia. Has sido profesor?
Al hilo, no he seguido mirando porque hoy estoy espeso y se me caen los párpados. Imagino que al hablar del plegamiento de proteínas habrás mencionado la Paradoja de Levinthal. Es una pequeña curiosidad que en su día, hace ya años, me llamó la atención tanto como para incluso escribir un pequeño articulillo en El Cedazo.
Saludos
Hola de nuevo Gencianal, lo que me gusta de los comentarios es este intercambio de conocimientos que a veces se produce. Como aficionado al tema (y tu sabes que simplemente soy esto) no me había encontrado con la Paradoja de Levinthal. He leido tu interesante escrito de El Cedazo que me ha dejado claro en que consiste la paradoja. Sin saberlo, intuitivamente ya me había buscado una respuesta desde hace tiempo. Yo no soy químico pero tengo firmemente arraigado que los átomos y moléculas tienen una vida geométricamente condicionada a su estructura electrónica y de orbitales y a su cinética. Vamos, que anatema de mí, siempre los veo como lo que llamo unas piezas de Lego: en pocas palabras, encajan como pueden encajar. Y eso elimina muchas alternativas de conformaciones. Es como la evolución biológica: de la bacteria al elefante hay muchos caminos teóricos por los que transitar, infinitos. Pero para encontrar los realizables hay que dividir por una potencia de 10 considerable. Y de hecho hay un camino, el real, que se llevó a cabo diríamos que de forma espontánea. Luego lo que parecía infinito no lo era tanto. Mientras que la bacteria necesitó muchos millones de años para llegar a elefante, pienso que las proteínas tienen una ayuda inestimable para su plegamiento (y estoy pensando en las que se sintetizan en el ribosoma celular. No sé cual es el proceso cuando pasa en un tubo de ensayo). Hay un catalizador fantástico, que es el ARN de transferencia, que se sabe la secuencia de aminoácidos y los va pegando con la ayuda del ARN ribosómico, uno a uno como quien se sabe un puzzle de memoria. Los enlaces peptídicos, los puentes de hidrógeno, las fuerzas de Van der Waals… se encargan del ajuste fino. El plegamiento de la molécula de la proteína es inmediato, automático y único. Incluso diría que “fácil”. Otra cosa sería cuestionarnos como se construyó la herramienta que lo hace. Y con eso llego a un personal convencimiento al ver que a lo largo de la historia de la humanidad lo que inicialmente es paradójico, el conocimiento te lo hace “natural”. Dicho esto también diré que, como lo anterior es una percepción personal, puedo estar equivocado. Espero continuar aprendiendo con comentarios tan interesantes como los tuyos. Muchas gracias por ellos.
De nada, jreguart. Gracias también a ti por “sacar el tema”
La aproximación que dices sobre las “piezas de Lego” no me parece nada mala en absoluto para “acercar” la química al profano. Pero no olvides que no son piezas de Lego al uso, porque elementos como el Cloro, por ejemplo, pueden hacer una tremenda versatilidad de enlaces. No es la misma pieza de lego el cloro del ácido perclórico que el del cloruro de sodio, por poner un ejemplo. Si nos vamos a elementos de transición, como los metales tipo platino, iridio, hierro… verás que algunos establecen unos complejos “que violan” toda la química clásica, los complejos de coordinación.
Esto sería respecto a las “piezas atómicas”. Las moleculares tienen una especie de conformaciones estéricas favorecidas. Por ejemplo, el Diagrama de Ramachandran explica las conformaciones proteicas de una cadena de aminoácidos en base a los ángulos planares de los enlaces entre aminoácidos. Y hay herramientas similares para otros compuestos, herramientas que desconozco porque no soy para nada un experto.
Ya te digo que a veces las conformaciones a veces son sorprendentes. Por ejemplo, la trifenilfosfina P(C6H5)6 y el trifenilmetano CH(C6H5)6 adoptan una curiosa conformación en “aspas de molino eólico”, aprovechando la torsión libre del enlace C-P y C-C, respectivamente, que sumada a las repulsiones estéricas (espaciales) hace que los anillos bencénicos se giren como si fueran el típico molino eólico con las aspas giradas para ganar eficiencia al capturar el viento; en vez de tener la clásica conformación planar de estos sistemas.
Saludos!
Al hilo de lo anterior (friki que es uno) estaba pensando que compuestos derivados de la trifenilfosfina (si se sustituye el fosforo, con cadenas que lo inmovilicen) podrían ser un morrocotudo nanorotor molecular en un flujo de electrones, jejeje.
Saludos!!
Hola de nuevo Gencianal, hoy es la segunda vez que me quito el gorro ¡va por ti! ¿Por qué no habré estudiado química? A mi me enseñaron mucho lo de Boyle-Mariotte, y lo de las mezclas químicas y cómo se formulaba el sulfúrico que era SO4H2 (ahora creo que es H2SO4) y poco más. Vamos, un rollazo. Desde hace poco estoy enterándome de la vida secreta de la química y es una pasada ¡Y yo sin enterarme de lo que pasaba dentro de mi cuerpo! Oye, con lo del nanomotor ¿se podría impulsar con un rayo lasser con la frecuencia y la longitud de onda adecuada? Incluso te puedes reir, je,je…
Gracias, jreguart, aunque inmerecidas, simplemente he estudiado algo que “tenía intrígulis”.
Has dado en el clavo. Justo a mí una de las cosas que me repatea de la química es que se ponga tanto el acento en enseñar “los rollos” (formulación y similares) y se pasen de lado todas estas pequeñas curiosidades; aunque en parte lo entiendo porque sin la formulación no te enteras de nada luego. Si te contara las que he visto en el trabajo… decimos de guasa que la química es la única ciencia en que dos más dos son cuatro pero 3 más tres pueden ser tanto cero como seis como nueve. Digamos que tiene, especialmente en ramas más “experimentales” como la Orgánica, todavía algo de ese aura del alquimismo.
Lo del nanomotor ya te digo que ni idea, jejeje, fue una “ida de olla”. Quizá la luz no sea suficiente y sea preferible “atacarlo” con pequeños iones. Por ejemplo, electrones o átomos ionizados de helio como en el experimento de Rutherford; buscando “acrecentar” el efecto con las repulsiones eléctricas. La pregunta es ¿para qué? O sea, en ¿qué se utiliza esta energía? Imagino que se emitiría luz infrarroja (torsión de enlaces = IR) pero ¿sería eficiente?
Hablando de eficiencia… tengo ganas de escribir un artículo sobre la ATP Sintasa, porque es una de las máquinas más perfectas y eficientes del mundo, su eficiencia es casi del 100%.
Saludos!
¡¡Ánimo y a por la sintasa Gencianal!!
Escribe un comentario