Cuando empezamos con esta longeva serie de Conoce tus elementos, pensé que sería de las que se leen porque están ahí, pero que no sería demasiado popular. Sin embargo, para mi sorpresa es una de las que más solicitáis cuando hay cierto tiempo entre un artículo y el siguiente –en este caso, todo retrasado por las vacaciones y la mini-serie sobre las ecuaciones de Maxwell–. El caso es que, por fin, tras hablar del hierro en mayo, llegamos al elemento de veintisiete protones y mi nombre favorito: el cobalto.
¿Sabías que se trata del primer metal para el que conocemos el nombre de su descubridor? ¿Que su nombre proviene de criaturas mágicas? ¿Que lo llevábamos usando varios milenios antes de darnos cuenta de su existencia? ¿Que su existencia requiere de una transmutación en el corazón de una supernova pero está en tu propio cuerpo? Pues si te quieres enterar, ya sabes.
El cobalto es, como el hierro, un metal de transición: se encuentra en la “zona media de la tabla”, entre los elementos con una enorme hambre de electrones y los que quieren librarse de ellos como sea para ser estables, pero más cerca, en su comportamiento, de los segundos. Por lo tanto, comparte muchas de las características del resto de los metales de transición: tiene varios estados de oxidación, es decir, es muy versátil en cuanto a los compuestos que puede formar; en su forma pura tiene el aspecto y comportamiento de un metal “estándar” –luego veremos el aspecto, pero es casi indistinguible de los otros– y, sobre todo, su versatilidad en las asociaciones que puede formar hace que no se encuentre jamás en su forma pura en la naturaleza.
Por lo tanto, es uno de esos elementos con los que hemos convivido durante milenios hasta darnos cuenta de que estaba ahí. A pesar de que otros metales de transición son tan reactivos como él, el cobalto ha sido más difícil de descubrir que otros porque no es tan abundante como ellos, aunque sí lo suficiente como para que lo utilizásemos sin darnos cuenta durante mucho tiempo, debido a que cantidades minúsculas de este metal hechizado son capaces de… pero bueno, bueno, que me adelanto a la historia.
Hemos visto ya en la serie que muchos metales de transición, en sus estados oxidados, tienen colores muy bellos, como sucedía con el pancromio, más conocido como vanadio. En el caso del cobalto, varios de sus compuestos de oxidación tienen un color azul bellísimo, que seguramente has visto muchas veces porque se sigue empleando para tintar vidrio, entre otras cosas. De hecho, hemos encontrado cerámica y vidrio tintados con compuestos del cobalto y fabricados alrededor del 2000 a.C.
Aunque no sabemos las rocas de donde extraían estos compuestos, hay cerámicas y vidrios tintados de este modo fabricados por los antiguos egipcios, persas, griegos, chinos…, prácticamente todo el mundo lo empleó durante mucho tiempo. Tanto es así que este color azul propio de algunos compuestos del cobalto es la “marca de la casa” de ciertos tipos de cerámica china, por ejemplo. Sin embargo, nadie tenía ni idea de quién estaba realmente dando el color azul a estos objetos.

Tetera china del siglo XIV tintada con cobalto (World Imaging/CC Attribution-Sharealike 3.0 License).
Desde luego, muchos ni se lo planteaban: al fundir ciertas rocas con el vidrio o la cerámica, aquello se volvía azul, ¿qué más daba la razón? Otros sí trataron de descubrir el porqué de ese color azul, pero llegaron a una conclusión errónea, como veremos en un momento. El problema es que, como he dicho antes, el cobalto no es muy abundante: menos del 0,003% de la corteza terrestre es cobalto; además, es difícil aislarlo y, para terminar de confundir la cosa, suele estar asociado, en las rocas, a otros metales conocidos antes que él.
En el caso de la cerámica y el vidrio azules, el cobalto solía estar asociado a un metal conocido desde la Antigüedad, el bismuto –del que hablaremos cuando le toque su turno en la serie, por supuesto–. Al encontrar casi siempre bismuto, un metal conocido, en las rocas que proporcionaban el color azul a estos objetos, la conclusión general era clara: el responsable del color azul era el bismuto. Fin de la cuestión durante siglos.
De hecho, durante muchísimo tiempo no se descubrió ningún metal nuevo, y probablemente ésa es una de las razones de que tampoco se descubriera el cobalto hasta muy tarde. Es una de esas situaciones en las que la pescadilla se muerde la cola: como no se descubre ningún metal nuevo, todo el mundo supone que la razón es que ya se conocen todos, no hay más metales nuevos. Como consecuencia, cualquier anomalía suele justificarse por uno de los metales ya existentes, ¡porque no hay más, todo el mundo lo sabe! Y así, claro, nadie descubre ningún metal nuevo y la idea falsa de que no hay ninguno persiste.

Georgius Agricola (1494-1555).
En el siglo XVI, un viejo amigo de la serie, Georgius Agricola, del que hablamos al hacerlo del flúor, llegó a esta misma conclusión errónea: el bismuto estaba presente en cantidades considerables en las rocas que proporcionaban el color a las cerámicas y vidrios en cuestión, luego era el responsable del color. Irónicamente, el propio Agricola había descrito una roca diferente y que este extraordinario mineralogista pensaba que no tenía nada que ver con el azul de las cerámicas: el cobaltum.
Los mineros alemanes conocían muy bien esta otra roca (en realidad, más de una diferente, pero bueno), y maldecían su nombre. Se trataba de un mineral que se encontraba en las minas junto a menas útiles de hierro y níquel, a menudo mezclada con ellas y similar a muchas otras. ¡Pero no era realmente como las demás! Esta roca maldita no sólo no proporcionaba metales útiles al procesarla –se obtenía un polvo sin valor alguno en vez de un metal–, sino que era incluso peligrosa: pulverizada era tóxica, y era corrosiva en el contacto con la piel.
Una roca parecida a otras útiles pero inútil y venenosa… la conclusión de los mineros era clara: se trataba originalmente de una roca normal, pero había sido transformada en este horror tóxico por los kobolds de las minas, unas criaturas mágicas y caprichosas. Había kobolds de muchos tipos, no sólo en las minas –en los barcos, en las casas, en los bosques, etc.–, con lo que su existencia explicaba casi cualquier cosa que pudieras imaginar: ¿se ha agriado la leche? Kobolds enfadados. ¿Encontramos una mena excelente en la mina? Kobolds amigables. En las minas, estas criaturas eran responsables de prácticamente todo lo inexplicable: ruidos extraños, minerales inusuales, explosiones de gas, lo que fuera.

Heinzelmann, el kobold doméstico del Castillo de Hudemühlen.
De modo que esta roca maldita era la roca de los kobolds, es decir, el cobaltum. Lo que los mineros no sabían, claro está, era que se trataba de una roca normal y corriente que llevaba ahí millones de años, y no era el producto de ningún hechizo por parte de criaturas mágicas. Hacía falta otra manera de mirar el problema, más profunda que la de Agricola y menos supersticiosa que la de los mineros.
Hizo falta esperar hasta el siglo XVIII para obtener la respuesta a la naturaleza del cobaltum y corregir la anterior respuesta errónea sobre el color de las cerámicas y vidrios azules. De modo que viajemos hasta la Suecia de 1730, uno de esos lugares y momentos de la Historia en los que la fertilidad científica es apabullante. Y ya que estamos allí, vayamos, por supuesto, a una mina.
La mina en cuestión era propiedad de un tal Georg Brandt, y lo hizo rico: Brandt encontró grandes cantidades de cobre y hierro. En la mina, desde luego, había kobolds, puesto que también allí se encontraba la roca maldita que podía ser venenosa y no producía ningún metal útil, sino ese estúpido polvo. No creo que esto preocupase mucho a Brandt, que no tenía que lidiar con ese cobaltum, pues era el propietario, no un minero, pero supongo que la existencia de esa roca era a veces tema de conversación, y parece ser que su hijo, del mismo nombre que el padre, lo recordaría más adelante. Imagino, por lo tanto, que la historia de los kobolds se había extendido por más sitios y no era únicamente alemana.

Roca hechizada por kobolds, alias cobaltita (Rob Lavinsky/CC 3.0 Attribution-Sharealike License).
Georg Brandt hijo se convertiría, años más tarde, en un mineralogista de primera, y sería una verdadera autoridad en la Casa de la Moneda de Estocolmo. Su conocimiento de los metales y aleaciones, además de las rocas de las que se obtenían, era extensísimo. Y, entre muchas otras cosas, Brandt se puso a estudiar el cobaltum de Agricola para determinar la verdadera razón de sus curiosas propiedades. Para ello realizó multitud de procesos con él, a altas temperaturas, tratando de separar sus distintos componentes.
Hoy en día sabemos, en gran parte gracias al trabajo de Brandt, aunque los mineros alemanes y Agricola lo desconocieran, que las rocas que llamaban cobaltum –y que hoy llamamos cobaltita– tenían esas propiedades debido a que estaban formadas por una combinación de cobalto, arsénico y azufre. La toxicidad de estas rocas se debía precisamente al arsénico que había en ellas, y no a un hechizo; la razón de que no se obtuvieran metales útiles era que, al realizar el mismo proceso que con otras rocas, el resultado era óxido de cobalto (II), CoO, que es un polvo nada impresionante.
De hecho, al tratar inicialmente el cobaltum, Brandt obtuvo lo mismo que todo el mundo: óxido de cobalto. Sin embargo, el sueco no se quedó ahí, e intentó aislar los elementos existentes en ese polvo. Al calentarlo a altísimas temperaturas en presencia de carbón vegetal, Brandt obtuvo un metal cuyas propiedades no coincidían exactamente con las de ninguno de los metales conocidos. A lo largo de los años siguientes, Brandt publicó varios escritos con los detalles de lo que iba descubriendo: el primero de ellos en 1735, el más detallado en 1748, Cobalti nova species examinata et descripta (El cobalto, nuevo elemento examinado y descrito). Brandt había descubierto el primer metal nuevo en mucho, mucho tiempo; tanto tiempo que Georg Brandt es el primer descubridor conocido de un metal. Aunque él obtuvo pequeñísimas cantidades de cobalto, su aspecto es algo así:

Cobalto al 99% (Alchemist-hp/Free Art License).
Como ves, su apariencia es muy mundana. El nombre, claro, es a la vez interesante y poco acertado: por una parte, no era el cobalto el responsable de las propiedades “hechizadas” del cobaltum, sino que lo era el arsénico. Sin embargo, que un elemento lleve el nombre de criaturas feéricas es algo estupendo y tiene mi total aprobación. Por cierto, no es el único, pero eso es otra historia y tendrá que esperar a otra ocasión: benditos sean los mineros alemanes y sus supersticiones.
Durante las numerosas manipulaciones y los experimentos realizados por Brandt con el nuevo elemento, se dio cuenta de algo muy curioso: bastaba añadir una minúscula cantidad de ciertos compuestos de cobalto al vidrio para darle un color azul bellísimo –el que hoy denominamos, por cierto, azul de cobalto–. Al examinar los compuestos que daban este color a vidrios y cerámicas, el sueco observó que en todas las ocasiones había cobalto presente (sus antecesores simplemente no habían sabido detectarlo), y no hacía falta bismuto para proporcionar ese color. Brandt no sólo había desentrañado el misterio del cobaltum, sino también corregido el error ancestral de asignar al bismuto la responsabilidad de ese color azul.

Azul de cobalto, CoAl2O4 (dominio público).
A partir de entonces, y sobre todo en el siglo XIX, el nuevo metal fue extraído y empleado de forma industrial precisamente para este propósito, ahora ya de forma consciente. El compuesto más empleado para ello era –y creo que sigue siendo– el aluminato de cobalto (II), CoAl2O4. La industria del cobalto no era voluminosa, pues no hacía falta una gran cantidad del metal para proporcionar este bello color, pero se trataba ya de un metal extraído industrialmente, y aunque el público en general no conociera la causa, estaban familiarizados ya con botellas de este color –incluso algunas marcas de licor las empleaban como elemento distintivo–.

Vidrio tintado con cobalto (dominio público).
Sin embargo, la principal utilidad industrial del cobalto sería otra bien distinta. En el siglo XIX se experimentó con aleaciones de muy diversa índole, una vez que se hizo obvio que añadir pequeñas cantidades de ciertos metales proporcionaba al acero diferentes propiedades, algunas muy útiles. El cobalto resultó proporcionar al acero resistencia a la corrosión y una mayor tolerancia a altas temperaturas. De modo que, poco a poco, fue aumentando el consumo de cobalto – pero no por el bello color azul de sus compuestos oxidados sino por la más vulgar, pero mucho más útil, capacidad de mejorar el acero en aleación.
Hoy en día la mayor parte del consumo de cobalto se destina precisamente a aleaciones: forma parte de piezas en motores de avión, prótesis médicas –como también sucedía con el titanio, ¿recuerdas?–, etc. Se sigue utilizando en menor cantidad para dar color a pigmentos, igual que antes, además de como catalizador en ciertas reacciones químicas, pero no hay comparación con su uso en aleaciones, que es lo que ha catapultado su producción mundial según ha ido aumentando el consumo de aceros durante el siglo XX:

Producción mundial de cobalto en toneladas métricas por año (dominio público).
Casi la mitad, por cierto, proviene de minas en la República Democrática del Congo, muy lejos de las minas alemanas que le dieron nombre. Pero, ya que no fue producido por criaturas subterráneas, ¿de dónde proviene este feérico metal?
Hombre, como todos los demás, de las estrellas, pero en este caso, a diferencia del hierro, no es posible que una estrella produzca cobalto durante su secuencia principal, es decir, durante la vida normal de la estrella. Es más, muy pocas estrellas pueden producir cobalto en ningún momento de su existencia. La razón la vimos al hablar del hierro, pero es básicamente que la transmutación de otros elementos en cobalto mediante la fusión es un desastre energético: consume mucha más energía de la que produce.
Por lo tanto, sólo hay un momento y lugar en el Universo en el que puede producirse cobalto: durante el colapso en supernova de una estrella gigantesca (allí hablamos también de la nucleosíntesis de elementos más pesados que el hierro). El proceso por el que se produce el cobalto es uno de los dos procesos de nucleosíntesis de elementos más pesados que el hierro: se denomina proceso-r, por “rápido”, porque hay otro más lento que él. Justo tras el colapso de la supernova, se liberan neutrones libres en una cantidad ingente: unos 1022 neutrones por cada cm2 y segundo. Muchísimos de ellos son absorbidos por núcleos cercanos y, aunque se forman núcleos inestables, el ritmo al que se reciben neutrones es tan grande que supera a la desintegración de los formados, de modo que al final se acaban formando, en muchos casos, núcleos estables de multitud de elementos, entre ellos el cobalto.
Finalmente, parte de esos núcleos salen despedidos cuando la supernova termina, y al cabo de muchos eones acaban en un sistema estelar distinto de una “generación estelar” posterior, como el nuestro. Sí, cuando la estrella se hunde sobre sí misma a un 23% de la velocidad de la luz, alcanza una temperatura cien mil veces mayor que la del núcleo del Sol y desencadena el proceso más violento y terrible que conocemos, entre otras cosas se producen átomos que utilizamos después para volver azules nuestras botellas. ¿No es el Universo maravilloso?
Me respondo yo mismo: sí lo es. Este elemento hechizado, producido durante el cataclismo estelar, desempeña un papel fundamental en nuestra vida, independientemente de botellas o cerámicas azules y aleaciones siderúrgicas. Al igual que una minúscula cantidad de cobalto puede cambiar el color de un vaso, una ínfima cantidad del metal es necesaria para nosotros: forma parte de la estructura de la cobalamina o vitamina B-12. No es algo que sirva únicamente en una parte de tu cuerpo – todas y cada una de las células necesitan cobalamina para realizar multitud de funciones correctamente, como nada más y nada menos la síntesis de ADN.
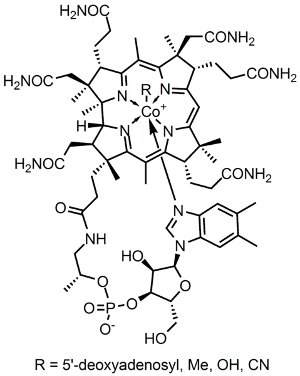
Vitamina B-12 (dominio público).
Las buenas noticias son que la cantidad de cobalto necesaria es muy pequeña, y con una dieta normal ingerimos la suficiente cantidad de este oligoelemento como para no tener que preocuparnos por el asunto. Es más –y los mineros alemanes que lean esto alzarán la ceja, finalmente resarcidos–, el cobalto puede ser peligroso en grandes cantidades; por otro lado, casi todo es peligroso en grandes cantidades. En el caso de este metal, afortunadamente, la cantidad necesaria es de unos cuantos gramos, y nadie consume tal cantidad de cobalto en circunstancias normales.
Aparte de reacciones alérgicas, que son más raras que a otros metales como el níquel, la ingesta excesiva de cobalto puede producir daños en los músculos cardíacos. Hace unas décadas se produjeron varias intoxicaciones debido al uso del metal para estabilizar espuma de cerveza –pero eso está prohibido hoy en día–, y a veces se producen inhalaciones excesivas de polvo de cobalto por parte de trabajadores que producen carburo de tungsteno (en el proceso se emplea cobalto). En resumen: que hoy en día, llevando una vida normal, no hay problema alguno con el cobalto. Los kobolds estarán decepcionados.
En la siguiente entrega de la serie seguiremos con otro metal de transición, el elemento de veintiocho protones: el níquel.
Para saber más:
