Bien, vamos a seguir con la serie sobre [Química Orgánica]. En el último artículo hablamos de los enlaces químicos; hoy vamos a hablar sobre las estructuras de Lewis, que son una representación muy útil para visualizar rápidamente las moléculas unidas con enlaces covalentes.
Primero vamos a explicar cómo funciona. En primer lugar tenemos que escribir el símbolo de un átomo y sus electrones de valencia representados como puntos a su alrededor.

Elementos representados con su estructura de Lewis. Imagen sacada de aquí
Para un enlace es lo mismo, pones dos átomos, uno al lado del otro, y lo que sale es lo siguiente:
¿Recordáis el enlace simple? Era la unión de dos átomos que compartían un único par de electrones, ¿verdad? Pues vamos a ver como se vería representado mediante las estructuras de Lewis:
Aquí vemos los electrones de un cloro (al que llamaremos cloro 1) como puntos y del otro (que llamaremos cloro 2) como “x”. Normalmente se usan siempre puntos, pero creo que es más fácil entenderlo, ¿no? Podemos ver ahora como el cloro 1 tiene 7 puntitos + 1 cruz del otro cloro (8 e- en total) y el cloro 2 tiene sus 7 cruces + 1 puntito del otro cloro (8 e- en total).
Muchas veces os encontrareis con que los pares de electrones compartidos dejan de representarse como dos puntos para representarse con una raya.
Y también (y es lo más común) convertir TODOS los pares de puntos en rayas como aquí puede verse:
Yo usaré siempre esta última (es la que me gusta más), pero puede que alguna vez ponga otra (depende de lo que encuentre…).
Bien, ahora hemos visto el caso del enlace simple, pero recordemos que había enlace doble y triple… ¿cómo se representan esos enlaces? Pues fácil, el doble (recordemos que habíamos puesto el O2 como ejemplo) se haría simplemente haciendo dos lineas en lugar de hacer una sola línea:
Y el triple, haciendo tres (recordemos nuestro ejemplo del nitrógeno)
Pero no sólo se forman enlaces covalentes entre dos átomos del mismo elemento, sino que también pueden formarse enlaces covalentes entre elementos distintos, por ejemplo algunos bastante conocidos:
Podemos ver que hay un oxígeno y dos hidrógenos. Como el oxígeno necesita ganar 2 electrones y cada hidrógeno necesita ganar solo 1e-, el oxígeno comparte un par de electrones con cada hidrógeno. ¿Veis por qué las estructuras de Lewis son útiles? Nos permiten ver con facilidad todo este razonamiento.
Otro ejemplo: el Agua oxigenada, también conocida como Peróxido de Hidrógeno (H2O2):
Por el mismo procedimiento de antes podemos ver que hay dos oxígenos, que cada uno necesita dos electrones para tener la configuración del Neón, y dos Hidrógenos que necesitan ganar 1e- para conseguir la del Helio, así que los dos oxígenos comparten un par de e- entre ellos y otro par con los Hidrógenos, teniendo así sus 6e- + 1e- del otro oxígeno +1e- de su hidrógeno.
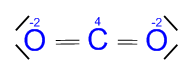
Otro ejemplo más: El famoso dióxido de carbono (CO2)
Vemos que el carbono tiene dos enlaces dobles con cada uno de los oxígenos.
Hemos visto ejemplos de moléculas con átomos del mismo elementos y moléculas con átomos de distintos elementos pero “simétricas”, vamos a ver un ejemplo de una molécula con átomos de distintos elementos y que además no presenta ningún tipo de simetría.
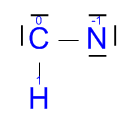
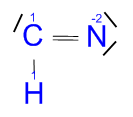
Ácido cianhídrico (HCN):
Aunque yo no lo haré aquí es recomendable que en vuestras casas los hagáis paso por paso, si no es fácil equivocarse. Por ejemplo, ¿por qué poner ese triple enlace? Si pusiéramos un enlace simple o uno doble tanto el carbono como el nitrógeno tendrían los ocho electrones en la capa de valencia que necesitan para tener la configuración de Neón, ¿no?
Bien, para evitar ese error (muy común) se puede hacer de dos formas, o hacerlo paso por paso como he sugerido antes (el carbono sólo tiene 4 e- en su capa de valencia, por lo que al compartir uno con el hidrógeno le quedan 3, y necesita 6, así que la única forma es compartir los tres con el nitrógeno). O de otra forma:
Contando electrones: ¿Cuántos electrones tienen los elementos por separado?
Para hacer esto es necesario saber como se hace (y que es) un factor de conversión. Un factor de conversión es una herramienta matemática muy usada en física o química. Se basa en la multiplicación de fracciones donde el numerador y el denominador son equivalentes (se puede expresar como que el denominador=nominador, por lo que la fracción siempre tendrá valor 1, por esto se puede multiplicar un número por tantos factores como se crea conveniente, ya que es igual que multiplicar por 1), la utilidad de esto suele ser el cambio de unidades.
Vamos a ver cómo usar los factores en nuestro caso:
 ·
· 
 ·
· 
 ·
· 
Los átomos se simplifican y nos queda el número de electrones por cada átomo (ahora parece una tontería, porque solo tenemos un átomo de cada elemento, pero cuando tenemos más nos puede ayudar mucho)
¿Total? 1+4+5=10e-, por lo tanto debe haber sólo 10 electrones en la molécula (dado que no tiene carga), así que analicemos los tres posibles casos:
Si solamente hubiera un enlace simple, ¿cuántos electrones tendríamos?
¡Correcto!, tenemos 7 líneas, que representan 2 electrones cada una, así que en total tendríamos 14, y debemos tener 10.
Si el enlace es doble pasamos a tener 12 (6 líneas con 2 e-):
Mientras que con el triple enlace sólo tenemos 5 líneas, por lo tanto los 10 e- que buscábamos. Véase:
Por cierto, si os habéis fijado, sobre los distintos átomos hay un número. Éste no debe confundirse nunca con la carga (la carga de un ion se indica prácticamente igual, por ejemplo el óxido se escribe O2-, el carburo C4-, etc…), pero los números que hay ahí indican el número de oxidación de un elemento. El número de oxidación (aunque tampoco nos importa demasiado en esta serie) se calcula siguiendo estas dos reglas:
- Se atribuyen todos los electrones compartidos al elemento más electronegativo (enlace a enlace).
- Se compara el número de electrones (habiendo hecho el paso anterior) con el número de electrones de este elemento.
Este artículo no tiene más secreto, pero para no terminarlo así voy a poner algunos ejemplos más. No obstante, si crees que ya lo has entendido a la perfección no tiene mucho más sentido que sigas leyendo, pero siempre es recomendable ver más ejemplos para familiarizarte con las estructuras de Lewis.
- Uno que es bastante conocido también, el Hexafluoruro de Azufre (SF6):
- Cloruro de Berilio (BeCl2)
Uno que aún no he puesto y que es muy importante para nosotros:
- Metano (CH4)
- Pentacloruro de Fósforo (PCl5)
Y bueno, creo que con esto ya hay bastante, ¿no?
Pues no, después de ver varias estructuras de Lewis hechas por mí, ahora te toca pensar a ti, así que los deberes para el siguiente artículo son escribir las estructuras de Lewis de los siguientes compuestos:
H2
I2
NO (monóxido de nitrógeno, no se rían de su nombre, pobrecito)
CHCl3
C2H6
C2H4
C2H2
Bien, pues esto es todo, hasta la próxima, donde, si todo va según lo previsto, deberíamos empezar ya con Química Orgánica, con los Hidrocarburos Saturados.

The [Química Orgánica] Introducción 3-Estructuras de Lewis by Roger Balsach, unless otherwise expressly stated, is licensed under a Creative Commons Attribution-Noncommercial-No Derivative Works 2.5 Spain License.









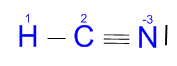

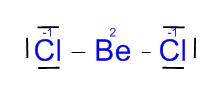




{ 12 } Comentarios
Muy bien explicado todo, pero me queda una duda. ¿Por qué se pone el número de oxidación encima del átomo?
Brigo, el número de oxidación aparece porque el programa con el que hago las estructuras no te deja quitarlo, el porqué esta encima y no debajo o a la derecha… pues ni idea, generalmente nunca se suele indicar el número de oxidación, ya que éste es importante en química inorgánica, y ahí no es tan frecuente dibujar las estructuras de Lewis. Así que realmente no se si se debe poner siempre encima (en el caso de que se ponga) o, como no se pone nunca el programa lo ha puesto ahí porque quedaba bien.
Roger
Gracias, por la aclaración, es que me tenía un poco despistado.
Roger, ¿por qué el Azufre del Hexafluoruro de Azufre tiene 12 electrones alrededor y el Fósforo del Pentacloruro de Fósforo tiene 10?
Mmonchi, éso, al igual que el número de oxidación pertenece a otra serie, la de química inorgánica (que, si esta serie gusta lo suficiente, probablemente caiga… pero ya veremos porqué además tengo pensada otra cosita que ya veré si funciona…). El problema está en que probablemente lo haya hecho mal, he puesto muchos ejemplos de formulación inorgánica en las introducciones sin haber explicado nada de ésta… (cómo digo, a lo mejor en un futuro).
Pero vamos a intentar resolverte la duda… sin entrar en detalles, sabemos que el Azufre pertenece al grupo 16*** (igual que el oxígeno) por lo tanto tiene 6 electrones de valencia, y que tanto el Azufre cómo el flúor son no-metales, por lo que formarán un enlace covalente. Ahora viene lo difícil, el flúor es mas electronegativo que el Azufre, por lo que, mal dicho (MUY MAL DICHO) el flúor es quien se queda con los electrones del Azufre, por lo tanto, para que el Azufre tenga la configuración del Neón debe “compartir” seis electrones.
Por otra parte lo mismo pasa con el Fósforo, es del grupo 15 (igual que el nitrógeno) y tiene 5 electrones de valencia, y en este caso, en lugar de Flúor reacciona con Cloro (que, aunque menos electronegativo que el Flúor es más electronegativo que el Fósforo) así que pasa lo mismo, sólo que el Fósforo sólo tiene 5 electrones para “compartir”.
***Y si no lo sabes (no pasa nada, yo tampoco me sé la tabla periódica) aquí tienes una: http://www.ptable.com/?lang=ca
Espero no haberte liado mucho Roger
Gracias, Roger. Entiendo que el Azufre (16) alcanza la configuración del Neón (10) y no la del Argón (18) porque le “da” sus seis electrones de la última capa a los seis átomos de Flúor en lugar de compartirlos. ¿Eso no es un enlace iónico?
No, el enlace es covalente, por esto he dicho que lo de que el Flúor se queda con los electrones está muy mal dicho (porque al ser covalente se comparten, pero cómo es más electronegativo, digamos, le pertenecen más al Flúor que al Azufre, pero pertenecen a los dos átomos) de modo que el Azufre realmente se queda con sus seis electrones más seis electrones del Flúor, pero la estabilidad del compuesto no se basa en que el Azufre tenga la configuración del Argón (Algo que sí que pasa, por ejemplo con el Sulfuro de Aluminio Al2S3) sino en que cada uno de los Flúor tiene la configuración del Neón.
Para no liarte mucho puedo decirte que todo eso se basa en los números de oxidación de cada elemento, los números del Azufre (igual que la mayoría de el grupo 16) son -2, 2, 4 y 6, eso quiere decir que cuando éste elemento sea el más electronegativo siempre intentará compartir 2 electrones de los que tiene (número -2) mientras que si está con otro elemento más electronegativo va a compartir 2, 4 o 6 electrones (es decir, en nuestro ejemplo, formará SF2, SF4 o SF6) el porqué… pues por caprichos de la madre naturaleza que hace que tener 2 electrones sea más estable que tener 1 o que tener 3…
Como digo es un tema que no va con esta serie y que probablemente intente tratar en otra (aunque como podrá ver cualquiera que sepa más de química es un tema que tampoco domino mucho).
Así que, si no has sacado nada en claro quedate con lo siguiente: -El enlace es covalente, no iónico, los electrones son compartidos entre el Azufre y cada átomo de Flúor -El Azufre comparte sus 6 electrones porque sí, aunque así no obtenga ninguna configuración de gas noble.
Siento no poder ser más claro Roger
Gracias Roger, lo que te pregunto es algo que nunca me quedó claro. Esperaré la serie de química inorgánica y mientras disfrutaré de esta.
Respecto a los del hexafloruro, que a mi tambien se me ha atrevasado, he encontrado una explicacion mas completa aqui:
http://www.quimitube.com/videos/enlace-covalente-excepciones-a-la-regla-del-octeto
Tampoco mucho mejor explicado, pero sumando una explicacion y otra me quedado mas tranquilo, ademas de que creo recordar que por aqui habia un video del hexafloruro de azufre, usado como gas en el que hacer flotar cosas, pero no recuerdo bien donde.
http://eltamiz.com/2007/03/30/hexafluoruro-de-azufre-en-accion/
¿Me podrian decir como se graficaria el sulfuro de aluminio por estructura de lewis?
Kiko, la estructura del Sulfuro de Aluminio (Al2S3) es S=Al-S-Al=S (es decir, dos aluminios unidos por un átomo de azufre con un enlace simple y luego un átomo de azufre unido a cada aluminio con enlace doble). Fíjate que el azufre necesita ganar dos electrones (o bien con un doble enlace o bien con dos enlaces simples) mientras que el aluminio solo tiene tres electrones disponibles por lo que su configuración estable es cuando los tiene los tres “ocupados”.
Saludos, Roger
Escribe un comentario