En los artículos anteriores de esta serie sobre la tabla periódica hablamos un poco de los átomos, el nacimiento de la tabla periódica y luego sobre el comportamiento de los electrones. Podría haber hablado de la tabla periódica a saco y sin entrar mucho al tema, pero muchas de las cosas que os explicaré os las tendríais que haber creído porque sí, y me gusta más que podáis entenderlo por vosotros mismos. En este artículo, por fin, me meteré dentro de la tabla y os hablaré de ella.
Antes quiero hacer un pequeño inciso: la IUPAC, Unión Internacional de Química Pura y Aplicada, se dedica, entre otras cosas, a sistematizar y ponerle nombres a las cosas. El problema está en que en química hay millones de cosas con nombres, los químicos salimos del todo el mundo, y, la verdad, hacemos lo que nos da la gana. En la química orgánica esto llega a niveles de pesadilla, un compuesto increíblemente simple puede llegar a tener una cantidad de nombres ingente. Esto lo digo porque yo os diré algunas cosas y citaré algunos nombres que quizá veáis que no se respetan (o no los respeto yo) en otro sitios. Por ejemplo, los lantánidos y actínidos, la IUPAC recomienda que se les llame lantanoides y actinoides… pero no he oído nunca a nadie usar ese nombre, y a mí no me gusta.

Versión larga de la tabla periódica, con los actínidos y lantánidos en sus lugares correspondientes.
Como sabéis, la tabla está ordenada en orden creciente de número atómico pero, ¿por qué tiene esa forma tan peculiar, y no es un cuadrado? La forma que tiene no es casualidad. También os habréis fijado en que los lantánidos y actínidos suelen estar fuera de la tabla, como si fueran distintos, los pobres. Muchos ya lo sabréis, pero lo cierto es que su lugar en la tabla no es ése: el lugar en el que deberían estar es en el cual están colocados en la tabla periódica de más arriba.
En la tabla que pongo a continuación veréis que está dividida en grupos según su configuración electrónica, o, mejor dicho, según la configuración electrónica de los electrones externos. Por ejemplo, en la parte de la izquierda del todo nos encontramos con todos los elementos que tienen los electrones externos en los orbitales s (menos el helio, que es “especial” y no se encuentra ahí). Ya hablaremos de los grupos más adelante.
Con esta tabla periódica es muy fácil ver el motivo por el cual los elementos están ordenados de esta manera y no de otra. Cuando hable, dentro de poco, de las propiedades periódicas, veréis que este ordenamiento es de todo, menos al aleatorio.
Por cierto, si buscáis bien, veréis que hay bastantes tipos de tablas periódicas, las hay en espiral, otras ampliadas, divididas en grupos, otras que destacan su abundancia en la Tierra, etc.
La tabla periódica está dividida en distintas filas y columnas: las columnas son los grupos, las filas, periodos. El comienzo de un nuevo periodo corresponde a la introducción de un electrón en el orbital s de un nuevo número cuántico principal (recordad, n). Para que lo veáis, en la tabla periódica hay 7 periodos, y en cada periodo, si os fijáis, a la izquierda del todo podéis ver cómo se encuentran los orbitales s, y conforme bajas por la tabla aumenta n. El número de elementos en cada periodo es el número de electrones necesarios para llenar esos orbitales. También podéis fijaros que n es el mismo para los orbitales s y p, pero una unidad menor para los d y 2 para los f (que recuerda que están situados en los periodos 6 y 7).
Los elementos más típicos y representativos son los que están en el bloque de los orbitales s y p, los del grupo d y f son los metales de transición y los metales de transición interna (o actínidos y lantánidos) respectivamente.
La tabla periódica que pongo a continuación, aparte de tener muchos números, es muy útil porque en cada celda de los elementos está incluida su configuración electrónica, justo encima del nombre del elemento. Todos los grupos (recuerda: columnas) tienen elementos con comportamiento similar, debido a que tienen todos configuraciones electrónicas parecidas; aun así recuerda que todos los elementos tienen sus peculiaridades, pero ya veréis que para determinados grupos podremos generalizar algunas cosas.
Los grupos se enumeran del 1 al 18; antes se usaba un sistema de números romanos y letras que personalmente encuentro un follón, encuentro más fácil sólo números. Los metales de transición interna no tienen un grupo numerado, por cierto. Esto es debido a que son muy parecidos entre ellos, más por periodo que por grupo; por eso se les agrupa y se les saca fuera, aparte de que la tabla queda mas cómoda sin ellos dentro.
El hidrógeno (Z=1) y el helio (Z=2) son dos elementos anómalos. Si bien el hidrógeno está bien situado según su configuración electrónica, su comportamiento es un tanto único y distinto al del grupo al que pertenece; sin embargo el helio es justo al contrario: no está donde le correspondería según su configuración electrónica, pero sus propiedades concuerdan muy bien en el grupo en el que está, el 18. El hidrógeno, por cierto, os lo podréis encontrar en distintos lugares según la tabla periódica que miréis, debido a su comportamiento único. Es suficientemente especial como para que le dedique un artículo para él solito.
Muchos grupos tienen nombre.
En esta serie les dedicaré un artículo a cada uno de ellos, así que los revisaremos juntos y con calma. El grupo 1 (sin tener en cuenta el hidrógeno) son los metales alcalinos, el 2, los metales alcalinotérreos, los grupos 13, 14, 15 y 16 suelen llamarse grupos del boro, del carbono, del nitrógeno y del oxigeno respectivamente, el grupo 16 tiene el poco común nombre de calcógenos, pero es muy poco usado, el grupo 17 són los halógenos y el 18, por fin, los gases nobles. El resto de la tabla son los metales de transición junto a los de transición interna.
Antes de nada, hay que saber que cuando se habla de los elementos en términos generales, pese a que no se dice siempre, se habla de ellos en condiciones TPEA, temperatura y presión estándares ambientales, 25ºC y 100kPa (casi 1 atmosfera, casi). Como podréis ver en muchas tablas, casi todos los elementos en esas condiciones son sólidos, sólo nos encontramos con 2 liquidos y 11 gases. La temperatura es importante dejarla bien clara porque hay dos metales, cesio y galio, que funden a 30 grados los dos, más o menos.
Hay una manera muy general de dividir la tabla: metales y no metales.
Ésta puede parecer muy simple pero, ¿qué es un metal? No es tan fácil el asunto, la verdad, y como en muchas otras cosas, la línea que separa unos de otros no es tan clara. A simple vista es muy tentador pensar características que puedan decir que algo es un metal, como la densidad, la dureza, el aspecto brillante, maleabilidad, ductilidad, conductividad térmica…
Pero el caso es que hay metales poco densos, metales muy blandos, substancias con aspecto metálico que no lo son, metales no muy dúctiles o maleables y no metales muy buenos conductores del calor.
¿Conductor? ¿Y de la electricidad? Aquí tenemos un buen criterio, pero, señoras y señores, ¡atentos!, conductividad eléctrica tridimensional, porque, cómo no, también hay elementos que conducen la electricidad bien y no son metales… pero lo hacen, por ejemplo, bidimensionalmente. El ejemplo más claro es el grafito, que es carbono.
El metal que mejor conduce la electricidad es la plata, mientras el uranio es el que peor la conduce; la diferencia entre ellos es grande, pero la diferencia entre el uranio y cualquier elemento no metálico conductor es abismal, en comparación. Para volver a tocar las narices, es importante que las condiciones de presión y temperatura estén bien claras, pues, a poca temperatura, al menos el estaño ya no la conduce (esto es una peculiaridad de este elemento en la que no entraré) y, a mayor presión, el yodo sí lo hace. Una buena manera de distinguirlos es la dependencia de la conductividad eléctrica con la temperatura, pues ésta disminuye rápidamente conforme aumenta la temperatura con los metales y con los no metales es al revés, aumenta con la temperatura.
Para los químicos son más importantes las características químicas del elemento en cuestión, en particular la tendencia a formar enlaces o la preferencia para formar cationes (iones con carga positiva). Sea cual sea el criterio que utilicemos, siempre habrán elementos que estarán en la frontera entre metal y no metal. Estos elementos que aparecen entre metales y no metales en la tabla periódica superior son conocidos como semimetales, antiguamente, y por fortuna ya no, conocidos también como metaloides. Estos, como supongo que ya queda claro por su nombre, no son metales ni no metales, sino que tienen propiedades entre ambos grupos.
En fin, una propiedad química muy común entre los metales, a pesar de que no siempre es cierta, es que tienen tendencia a ceder electrones, es decir, suelen formar cationes. Los no metales suelen formar aniones, pero, lo dicho, no es una regla, aunque va muy bien para hacer una clara distinción inicial entre ellos.
Propiedades periódicas
Por fin, veámoslas. Que yo sepa las propiedades periódicas no suelen ser muy conocidas, pese a ser muy importantes. También debo decir que, según en qué sitios mires, encontrarás unas u otras, la verdad es que hay varias que están relacionadas.
Propiedades metálicas. Es sobre lo último que hemos hablado. Básicamente, en general aumenta hacia la izquierda y hacia abajo en la tabla periódica. En otras palabras, cuanto menor sea el grupo y mayor el periodo del elemento en cuestión, más carácter metálico tendrá éste en general. Los metales alcalinos podrían considerarse como los metales más metálicos, pues sus propiedades son de diccionario, casi, casi.
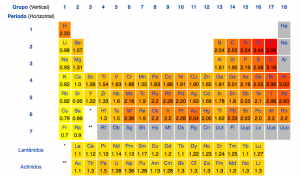
El radio atómico. Básicamente se podría definir como el tamaño de un átomo, a mayor radio, mayor volumen. Si recordáis lo que os expliqué en el artículo anterior, sabréis que la posición de los electrones la definimos en términos de probabilidad, es decir, no hay una frontera entre átomo y “no átomo”. Es por eso que no hay una sola definición de radio atómico, sino que hay varias definiciones. Por un lado, tenemos el radio covalente, que es la mitad de la distancia que hay entre dos núcleos iguales unidos mediante un enlace covalente. Veámoslo con un ejemplo, con valores inventados: si tenemos la molecula H2, medimos la distancia entre los dos núcleos y obtenemos un valor de 3, entonces el radio covalente del átomo de hidrógeno es 1,5. Otra definición es el radio de van der Waals, que es lo mismo que el radio covalente sólo que en este caso los dos átomos NO están unidos mediante ningún enlace. El radio metálico es igual, sólo que se usa para los átomos que se encuentran en un metal sólido. El radio iónico es de nuevo lo mismo, pero con los iones de los átomos, cosa que tiene más chicha, ya que no hay un solo ion por átomo. De este último hablaré por separado.
El que suele utilizarse normalmente es el radio covalente. La imagen siguiente contiene el radio atómico en angstroms (10-10m) de los grupos principales.
Observad la tendencia: cuanto más arriba y a la derecha, más pequeño resulta ser el átomo, y al revés. Lo normal sería pensar que el radio atómico debería crecer conforme aumenta el número atómico, pero no sólo no resulta así, sino que dentro del mismo periodo el radio disminuye. Si has estado atento, quizá puedas saber ya por dónde van los tiros, la configuración electrónica entre otras cosas. Lo mejor es usar ejemplos para ver cuál es el motivo.
Pero antes tengo que introducir un nuevo concepto, la carga nuclear efectiva, Zf. Veréis, aunque un átomo tenga 20 protones, no todos los electrones sufrirán la misma atracción. Esto es debido al efecto pantalla o apantallamiento. Este efecto es lo que parece a simple vista: es la atenuación de la carga nuclear debido a la presencia de electrones entre los protones y los electrones más externos. Vaya, que un electrón más externo sentirá una carga nuclear menor a la real, la carga que siente es la carga nuclear efectiva.
¡Ejemplos! Empecemos con el litio, este elemento tiene una configuración electrónica 1s2 2s. El tamaño aparente del átomo depende del tamaño del último orbital, el más externo, en este caso el 2s. El electrón de este orbital no siente una carga nuclear de 3, sino menor, debido al apantallamiento provocado por los dos electrones más internos. El berilio, que está justo al lado del litio, tiene un protón más y su configuración electrónica es 1s2 2s2. El orbital más externo es el mismo que el del litio, por lo que el radio atómico no debería ser mucho mayor que el del litio, incluso debería aumentar debido a las repulsiones electrónicas… ¡pero ahora tenemos un protón más en el núcleo y el electrón añadido está en el mismo orbital! En consecuencia, el orbital se contrae, y el resultado es ¡un radio atómico menor!
Conforme se sigue un periodo, la contracción aumenta, todos los orbitales se contraen conforme aumenta Z hasta que n aumenta debido a que se han llenado ya todos los orbitales de ese nivel energético. A la que el número cuántico n principal aumenta, el tamaño del orbital del que hablemos siempre será mayor que el de n menores, sumado al mayor tamaño del orbital externo, todos los electrones que antes eran externos ahora pasan a ser internos y ahora apantallan los externos, por lo que la diferencia de radio atómico de un gas noble y el elemento con Z inmediatamente superior es muy grande. Básicamente, al pasar de la derecha de la tabla periódica a los elementos de la izquierda pasamos de tener un atomillo a tener un señor átomo. Todo esto se complica conforme aumenta Z, empiezan aparecer los orbitales d, que no apantallan tan bien como los otros orbitales, los átomos tienen distintas anomalías en sus configuraciones electrónicas, ocurren efectos relativistas, etc. Pero, en general, la tendencia es la siguiente: cuanto mayor Z y menor grupo, mayor radio atómico. En resumidas cuentas, cuanto más abajo y a la izquierda de la tabla, más grande es el átomo en cuestión.
Supongo que todos imagináis que la importancia del radio atómico es tremenda: distancias de enlace, densidades, etc. Más adelante veremos su importancia a la hora de reaccionar… Vamos, que toda esta explicación no es por gusto.
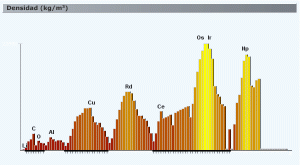
Densidad en función de Z. Obtenido de http://www.acienciasgalilei.com/qui/formularios/propiedades-atomo.htm
Esta propiedad (el radio atómico) es muy importante para explicar otra de las sustancias, ya hablando de cosas macroscópicas: la densidad de los elementos. Es muy fácil de entender que un elemento con mayor Z y poco radio atómico será mucho más denso que un atomo muy ligero y con radio atómico alto. Gráfico al canto a la izquierda. Se ven claramente las periodicidades, también pueden observarse alguna que otra anomalia, como la del cerio, pero en general se ven las tendencias.
En los metales de transición es una propiedad interesante de la que hablaré en su correspondiente artículo. Por supuesto, hablar de la densidad de los elementos es algo difícil de comparar para según qué elementos, pues hay elementos que son gaseosos, otros no siempre se combinan de la misma manera, etc, pero lo interesante era fijarse en una propiedad que sí puedes observar. Curiosidades: el hidrógeno es el elemento más ligero y el gas de hidrógeno es el gas más ligero que existe. El osmio y el iridio son dos metales muy, muy densos, los cuales suelen aparecer al unísono como metal más denso, si bien a mí me enseñaron que lo es el osmio. Además de su densidad tremenda, son tremendamente raros.

Comparativa entre radios atómicos e iónicos de distintos átomos. Observad el cambio entre los metálicos como el litio (Li) y los no metales como el flúor (F).
Volviendo a radios, el radio iónico, como ya he dicho, lo comento aparte porque, al igual que el radio covalente, es muy importante. Es fácil imaginarse las consecuencias de la formación de algunos iones, un átomo grande, metálico, con un solo electrón externo y que lo pierde, es fácil imaginarse que lo que tendremos es un átomo con carga positiva y de un tamaño menor. Y lo mismo va para un átomo de la derecha de la tabla, pero justo al revés. En la imagen de la derecha, una pequeña comparativa de tamaños; observad que algunos elementos pierden o ganan electrones. Esto es muy importante, porque hay bastantes sustancias formadas básicamente como un apelotonamiento de iones, conocidas como sustancias iónicas.
Esto, aunque pueda resultar un poco chocante al principio, es algo que hay que saber: el enlace iónico NO existe. Una sustancia como la sal común, NaCl, no es más que un apelotonamiento de Na+ y Cl-, entre ellos sólo hay atracción entre cargas, no hay enlaces. Pero que la cosa sea así no les resta importancia, hay multitud de sustancias iónicas y muchas de ellas muy importantes, y, por supuesto, el tamaño de los iones que las forman es muy importante. Naturalmente, un átomo tiene o puede tener varios radios iónicos, dependiendo de los electrones que pueda ganar o ceder. El sodio, Na, siempre pierde uno, el oxigeno, O, suele (que no siempre) ganar dos.
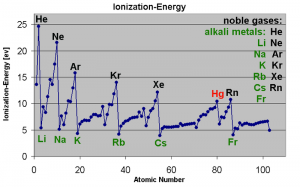
Gráfico de la energía de ionización. Puede observarse la tendéncia general junto con las distintas anomalias entre picos.
Energía de ionización. Es la energía que hace falta para arrancarle el electrón más externo a un átomo. Lo general es que cuanto mayor es un átomo, más fácil es arrancárselo. A los gases nobles, que no suelen reaccionar con nada, que tienen todos los orbitales llenos y son relativamente pequeños, cuesta una barbaridad quitarles un electrón. Podemos hablar, por supuesto, de la primera energía de ionización, segunda, tercera, etc. Como siempre, es más fácil arrancar electrones externos que están muy solos. El litio, con configuración electrónica 2s, está prácticamente chillando para que se lo quiten, pero su segunda energía de ionización es enorme; el flúor, que la tiene 2s2 2p5 y al que sólo le falta un electrón para completar sus orbitales, no quiere perderlo, ¡quiere ganarlo! En consecuencia, su energía de ionización será bastante elevada. Como en todas las propiedades, nos encontramos con anomalías y cosas que se salen de las tendencias generales. En general, la energía de ionización varía al contrario que el radio atómico: cuanto mayor es Z y mayor el periodo, menor es la energía de ionización. Esta propiedad es indicadora de la capacidad de un elemento para formar cationes. Su contraria es la siguiente propiedad.
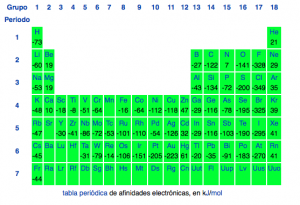 Afinidad electrónica. En esta propiedad suelen haber unos follones interesantes por culpa del signo. Veamos: la afinidad electrónica es parecida a la energía de ionización, pues es la energía necesaria para agregar un electrón al orbital desocupado de más baja energía de un átomo libre. En otras palabras, si buscas valores de afinidades electrónicas te encontrarás con que a veces aparecen con signo positivo y otras veces con signo negativo, no hay más que comparar las paginas de wikipedia en español y en ingles. Esto es debido al sentido en el que se considera la reacción. Me explico: si es positivo indica la energía que hace falta para arrancarle un electrón a un anión, si es negativa es la que he descrito más arriba. Aviso que para los químicos un signo negativo en una energía implica que es una energía que se desprende del sistema, en este caso añadir un electrón a un átomo suele ser un proceso exotérmico. ¡Esto incluye los átomos alcalinos como el litio y sodio! Aparentemente, esto parece ser contradictorio con lo que se suele enseñar, pero hay que tener en cuenta que la formación de un anión de un átomo no metálico suele ser un proceso muchísimo mas exotérmico.
Afinidad electrónica. En esta propiedad suelen haber unos follones interesantes por culpa del signo. Veamos: la afinidad electrónica es parecida a la energía de ionización, pues es la energía necesaria para agregar un electrón al orbital desocupado de más baja energía de un átomo libre. En otras palabras, si buscas valores de afinidades electrónicas te encontrarás con que a veces aparecen con signo positivo y otras veces con signo negativo, no hay más que comparar las paginas de wikipedia en español y en ingles. Esto es debido al sentido en el que se considera la reacción. Me explico: si es positivo indica la energía que hace falta para arrancarle un electrón a un anión, si es negativa es la que he descrito más arriba. Aviso que para los químicos un signo negativo en una energía implica que es una energía que se desprende del sistema, en este caso añadir un electrón a un átomo suele ser un proceso exotérmico. ¡Esto incluye los átomos alcalinos como el litio y sodio! Aparentemente, esto parece ser contradictorio con lo que se suele enseñar, pero hay que tener en cuenta que la formación de un anión de un átomo no metálico suele ser un proceso muchísimo mas exotérmico.
Como siempre, anomalías por doquier. El berilio, por ejemplo, lo es muy poco y es debido a que los electrones del orbital 2s apantallan a cualquier electrón que quiera añadirse al orbital p, mientras que el carbono tiene más afinidad electrónica de la que debería, debido a que si gana un electrón tendrá el orbital 2p lleno hasta la mitad, una configuración más estable de lo normal y eso hace que el átomo tenga más ganas de lo normal de ganar electrones, la misma razón por la cual el nitrógeno, con configuración 2p3 tenga tan pocas ganas de ganar electrones.
Al igual que en las energías de ionización, podemos encontrar afinidades electrónicas para uno, dos o más electrones, cosa que puede ser interesante. Por ejemplo, la formación del ion O- es un proceso bastante exotérmico, pero pasar del O- al ion óxido, O-2- es muy endotérmico, lo cual resulta una sorpresa, pues ese ion sí que existe… pero claro, solamente puede hacerlo si tenemos al lado alguna fuerza de mayor magnitud, como lo es la formación de una red cristalina.
Electronegatividad. Ya la última propiedad periódica… ¡queda poco! Es la propiedad de un átomo de atraer un electrón o de desplazar la densidad electrónica de otro u otros átomos hacia él. Que quede claro que es un concepto relativo, no se puede medir de forma absoluta, así que los números que podéis encontrar son números arbitrarios que se usan para poder compararse entre ellos, además de que hay varias escalas (yo usaré la de Pauling).
Por ejemplo, el átomo más electronegativo, el flúor, tiene una electronegatividad de 4, simplemente 4, lo que significa que es mas electronegativo que el oxígeno, que la tiene de 3,4.
Veamos un ejemplo: el HCl, ácido clorhídrico (lo que tienes en el estómago, junto a otras cosas). Entre los dos átomos (H y Cl) hay un enlace covalente (muy burdamente, el cloro y el hidrógeno comparten un electrón cada uno), pero la densidad electrónica está desplazada hacia el cloro porque éste es más electronegativo. Esto hace que, aunque la molécula sea neutra, el átomo de cloro tenga una carga formal negativa y el hidrógeno positiva.
Es muy importante esta propiedad. Un nuevo ejemplo que os dejará las cosas más claras que el agua: el agua, H2O. El oxigeno es más electronegativo que el hidrógeno, esto hace que los electrones de los enlaces queden atraídos hacia él, cosa que hace que el oxigeno tenga carga -2 y los hidrógenos carga + cada uno. Las implicaciones de esto son abismales, por cierto. Para que te lo imagines, si esto no fuera así el agua no sería líquida a la temperatura ambiente y no sería buen disolvente. ¿Te he convencido? Varía exactamente igual que la energía de ionización.
La electronegatividad se explica de la misma manera que la afinidad electrónica: un elemento con una configuración electrónica en la que le falte poco para tener una configuración muy estable será más electronegativo que otro al que le vaya mejor soltar electrones. El oxígeno y el flúor necesitan dos y un electrón respectivamente para tener esa ansiada configuración, los átomos de hierro suelen estar encantados de ceder los suyos, y, a la que te descuidas, el hierro se oxida y lo mismo casi cualquier metal con el que se cruce el oxígeno. Es ésta una propiedad utilísima para predecir o explicar el comportamiento de muchas moléculas, incluso su reactividad. El flúor, el átomo más electronegativo de todos, se ha ganado el título a la fuerza porque… ¡cuidado con el flúor! Yo en mi vida lo he visto en persona y pocas ganas tengo: es muy, muy peligroso, le arrancará un electrón a quien sea que se le cruce. En otras palabras, es muy reactivo y lo hace con ganas, incluso después de tener una configuración estable es peligroso, el ion F- es tremendo, presente en un ácido débil (de lo que ya hablaré algún día lejano) como el ácido fluorhídrico, HF, se come hasta el cristal y pobre de aquel al que se le derrame un poco encima, porque le esperan unos dolores de campeonato… si es que no pierde algún miembro por el camino.
Bueeeeeeno, ha costado pero ¡ya hemos repasado la tabla periódica! Me como el sombrero (expresión que he plagiado a Pedro) si no has aprendido algo. ¡Enhorabuena si te has leído el articulo entero sin parar y habiéndolo entendido todo a la primera!
Te dejo una pequeña chuleta al lado para que puedas recordar fácilmente como varían algunas de las distintas propiedades periódicas..
En fin, espero que os haya gustado y que hayáis aprendido algo. Nos vemos en el siguiente artículo, en el que empezaré a hablar del átomo del elemento más abundante y más simple: el hidrógeno.

The La tabla periódica IV – Propiedades. by , unless otherwise expressly stated, is licensed under a Creative Commons Attribution-Noncommercial-No Derivative Works 2.5 Spain License.








{ 5 } Comentarios
Muy interesante. He aprendido un montón de cosas. Sabía que el agua es una molécula polar, pero eres el primero que me explica porqué.
Brigo, sabes el de los osos, ¿no? Los osos polares son los que se disuelven bien en agua; los bipolares a veces sí, a veces no
Excelente artículo, muy buena explicación y muy claro (casi) todo después de esto.
Saludos
muy util
eu igual, corte el hidrogeno no es un metal, de hecho es un no metal
Escribe un comentario